POTENCJOMETRIA
Ćwiczenie P - 1
Wyznaczanie charakterystyki elektrody szklanej
Celem ćwiczenia jest wyznaczenie zależności potencjału elektrody szklanej od pH roztworu i określenie zakresu jej stosowalności w pomiarach pH.
Opis stanowiska badawczego:
Elektroda szklana
Elektroda kalomelowa
Potencjometr (pH-metr)
Roztwór NaOH o stężeniu 0,2 mol/dm3
Roztwór mieszaniny kwasów: CH3COH, H3PO4, H3BO3 o stężeniu 0,04 mol/dm3 względem każdego z nich
Wykonanie ćwiczenia:
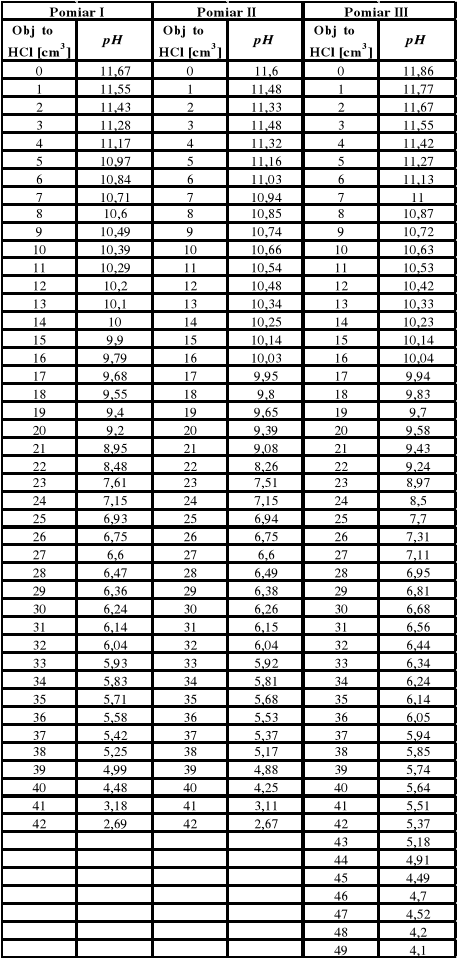
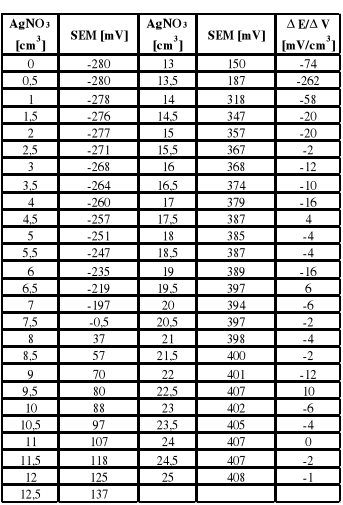
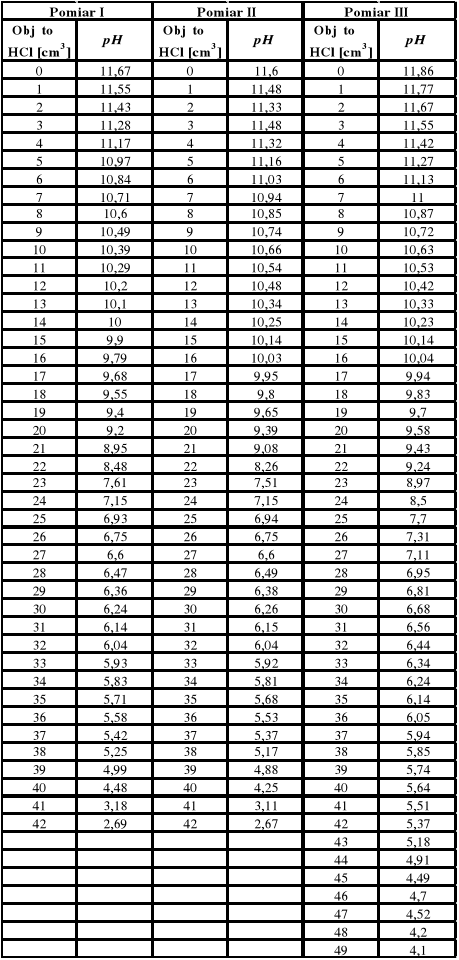
Do siedmiu zlewek o pojemności 100 cm3 odmierzam roztwór kwasów o stężeniu 0,04 mol/dm3 i roztwór wodorotlenku sodowego o stężeniu 0,2 mol/dm3 w ilościach podanych w tabeli 1.
Tabela 1
Skład roztworów buforowych
Lp. |
pH buforu |
Objętość roztworu kwasów [cm3] |
Objętość roztworu NaOH [cm3] |
Wartość zmierzonej SEM [mV] |
1 2 3 4 5 6 7 |
1,98 3,29 4,56 5,72 6,80 7,96 9,15 |
50 50 50 50 50 50 50 |
5 10 15 20 25 30 35 |
-325 -292 -162 -130 -57 50 169 |
Po dokładnym wymieszaniu otrzymuje się szereg wzorcowych roztworów buforowych. Zaczynając od roztworu o najniższej wartości pH, elektrody zanurza się kolejno do poszczególnych roztworów i notuje wskazania phametru w mV. Po każdym pomiarze elektrody spłukuje się wodą: lekko ściąga się z nich bibułą wiszące krople wody i zanurza się w następnym roztworze.
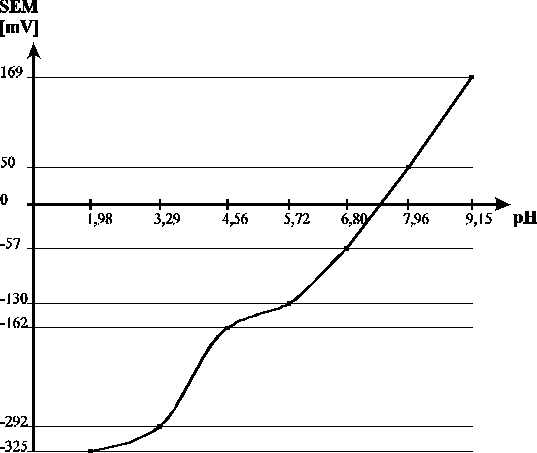
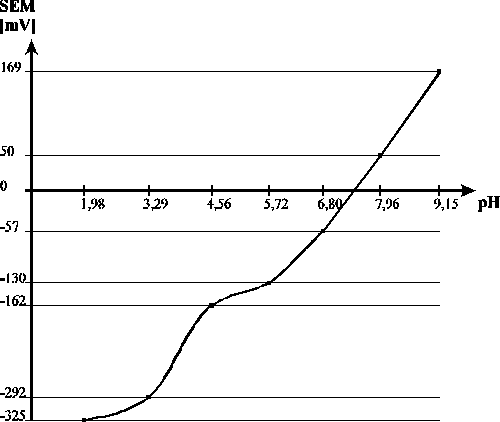
Krzywa wzorcowa elektrody szklanej
Wnioski:
Prawidłowość reagowania elektrody szklanej określa się za pomocą wykresu wzorcowania (jak wyżej) lub reagowania elektrody. Nachylenie linowej części krzywej jest stałe, co określa czułość elektrody i może być opisane równaniem Nernsta.
Badana elektroda szklana może być stosowana w zakresie pH 5,72 do 9,15 ponieważ w tym przedziale zachowuje prostoliniowość wykresu.
Wartość siły elektromotorycznej wody wodociągowej wynosi -34 mV a wody destylowanej -109 mV. Siła elektromotoryczna ogniwa wynosi -75 mV. Z wykresu odczytujemy wartość pH która wynosi 6,6.
Ćwiczenie P - 3
Oznaczanie równocześnie występujących jodków i chlorków metodą potencjometrycznego miareczkowania strąceniowego
Celem ćwiczenia jest oznaczenie zawartości jodków i chlorków w próbce otrzymanej do analizy.
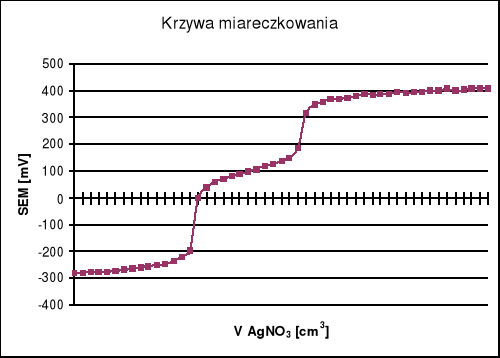
Podstawą metody są reakcje strąceniowe jodków i chlorków pod działaniem jonów srebra. Oznaczanie polega na badaniu zmian potencjału elektrody srebrowej podczas dodawania azotanu srebra do analizowanego roztworu.
Opis stanowiska:
Roztwór AgNO3 o stężeniu 0,1 mol/dm3
Elektroda srebrowa
Elektroda kalomelowa
Klucz elektrolityczny napełniony roztworem KNO3 o stężeniu 0,1 mol/dm3
Potencjometr
Wykonanie ćwiczenia:
Przygotować analizowany roztwór do miareczkowania. W tym celu do zlewki o pojemności 250 cm3 przenieść analizowaną próbkę i uzupełnić wodą destylowaną do objętości 150 cm3.
Zbudować ogniwo pomiarowe, zanurzając w miareczkowanym roztworze elektrodę wskaźnikową (srebrową) i elektrodę porównawczą (nasyconą elektrodę kalomelową) (NEK) z kluczem elektrolitycznym.
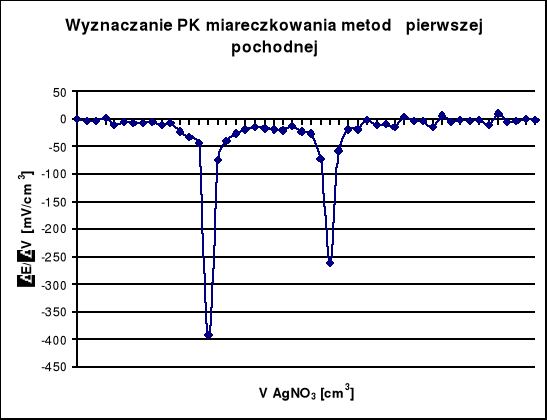
Miareczkować próbkę roztworem AgNO3 o stężeniu 0,1 mol/dm3 dodając roztwór w proporcjach 0,5 cm3 oraz notując w tabelce sumaryczną liczbę dodanych centymetrów sześciennych i odpowiadającą jej wartość SEM.
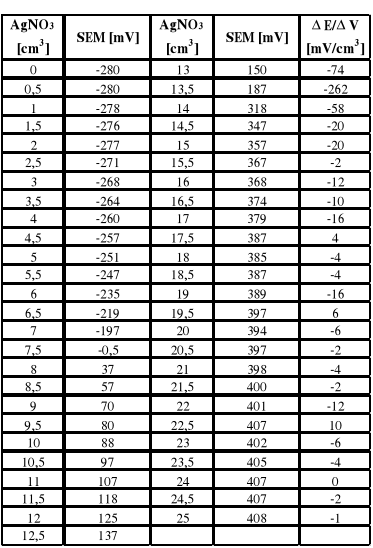
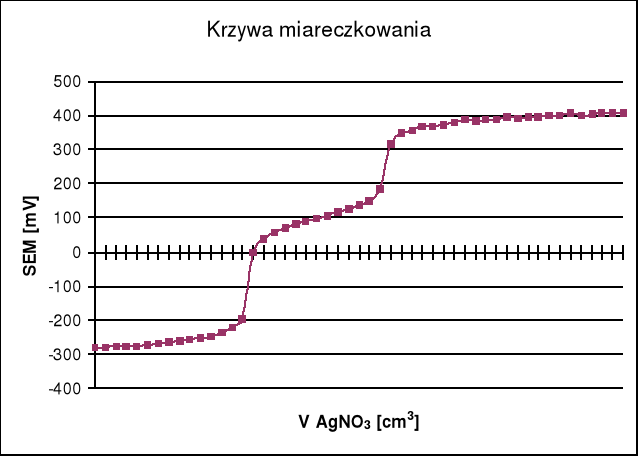
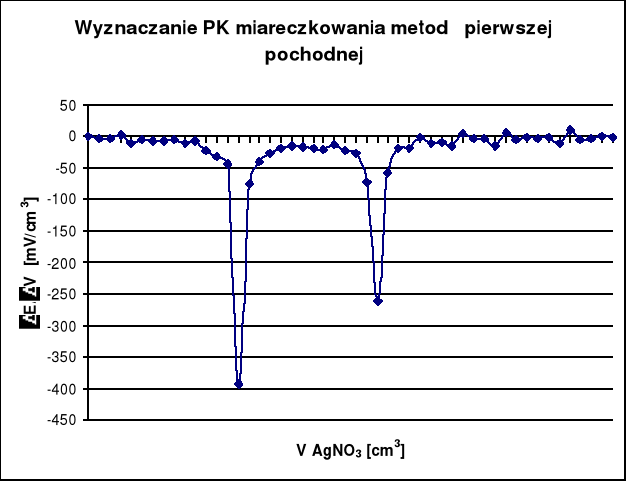
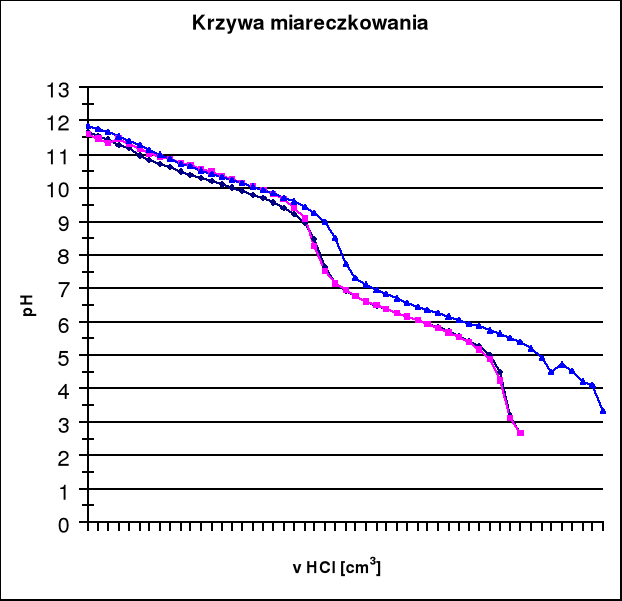
Z powyższych wykresów wynika że PK miareczkowania jodków zachodzi po zużyciu 7,3 cm3 a AgNO3 a dla chlorków po zużyciu 6,4 cm3 (13,7 - 7,3 = 6,4) AgNO3.
Obliczam zawartość jodków:
Cm = ms *1000 / Mcz * v CAgNO3 = 0,1 mol/dm3
ms = Mcz * CAgNO3 *VAgNO3 / 1000 VAgNO3 = 7,3 cm3
ms = 126,9 * 0,1 * 7,3 / 1000 = 0,9263g = 92,63 mg
Obliczam zawartość chlorków:
Cm = ms *1000 / Mcz * v CAgNO3 = 0,1 mol/dm3
ms = Mcz * CAgNO3 *VAgNO3 / 1000 VAgNO3 = 6,4 cm3
ms = 35,5 * 0,1 * 6,4 / 1000 = 0,2272g = 22,72 mg
Badana próbka zawiera 92,63 mg jodków i 22,72 mg chlorków.
Ćwiczenie P - 6
Oznaczanie zasadowości wody metodą miareczkowania potencjometrycznego
Oznaczanie zasadowości polega na oznaczaniu zawartości związków reagujących zasadowo wobec fenoloftaleiny i oranżu metylowego. Zasadowość tych związków jest równoważna ilości miligramorównoważników kwasu mineralnego, zużytego do miareczkowania próby w obecności odpowiedniego wskaźnika lub dokładniej do określonej wartości pH.
0 4,5 8,3 14 pH
Obliczam zasadowość Zp oraz Zm
w milivalach
VpI = 22 cm3 Zp = Vp * 100 / V ZpI = 22 [mval/dm3]
VpII = 22,3 cm3 Zp = Vp * 100 / V ZpII = 22,3 [mval/dm3]
VpIII = 24,3 cm3 Zp = Vp * 100 / V ZpIII = 24,3 [mval/dm3]
VmI = 39,6 cm3 Zm = Vm * 100 / V Zm = 39,6 [mval/dm3]
VmII = 40 cm3 Zm = Vm * 100 / V Zm = 40 [mval/dm3]
VmIII = 45 cm3 Zm = Vm * 100 / V Zm = 45 [mval/dm3]
w stopniach:
ZpI = 2,8 * VpI * 100 / V ZpI = 61,6 [stopni]
ZpII = 2,8 * VpII * 100 / V ZpII = 62,44 [stopni]
ZpIII = 2,8 * VpIII * 100 / V ZpIII = 68,04 [stopni]
ZmI = 2,8* Vm * 100 / V ZmI = 110,88 [stopni]
ZmII = 2,8* Vm * 100 / V ZmII = 112 [stopni]
ZmIII = 2,8* Vm * 100 / V ZmIII = 126 [stopni]
V = 100 cm3 - objętość wody pobranej do miareczkowania
Vp - objętość HCl zużytego na miareczkowanie do pH = 8,3 [cm3]
Vm - objętość HCl zużytego na miareczkowanie do pH = 4,5 [cm3]Zp Zm
Średnia arytmetyczna zbiorowości próbnej:
![]()
x = 22+22,3+24,3 / 3 = 22,86 x = 39,6+40+45 / 3 = 41,53
Wariacja zbiorowości próbnej
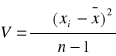
; n-1=k - liczba stopni swobody
V = (22 - 22,86)2 + (22,3 - 22,86)2 + V = (39,6 - 41,53)2 + (40 - 41,53)2 +
+(24,3 - 22,86)2 = 3,1268 / 2 = 1,5634 +(45 - 41,53)2 = 18,1067 / 2 = 9,0533
Odchylenie standardowe pojedynczego wyniku
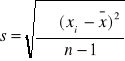
s = (1,5634) ½ = 1,2503 s = (9,0533) ½ = 3,0088
Odchylenie standardowe średniej arytmetycznej
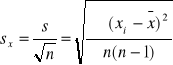
sx = [3,1268 / 6]1/2 = 0,7218 sx = [18,1067 / 6]1/2 = 1,7371
Względne odchylenie standardowe, charakteryzuje wielkość rozrzutu wyników
![]()
sr = 1,2503 / 22,86 = 0,0546 sr = 3,0088 / 41,53 = 0,0724
Przedział ufności:
95% dla k = 2 tstudenta = 4,303
![]()
[ ]
x = 22,86 ± 4,303*0,7218 = x = 41,53 ± 4,303*1,7371=
= 22,86 ± 3,1059 [ ] = 41,53 ± 7,4747 [ ]
Zp = 22,86 ± 3,1059 [mval/dm3] Zm = 41,53 ± 7,4747 [mval/dm3]
Lp. |
Wyniki oznaczania zasadowości |
Rodzaj i zawartość jonów powodujących zasadowość |
||
|
|
Z OH- |
Z CO23- |
Z HCO3- |
1 2 3 4 5 |
Zp = 0, Zm > 0 2Zp = Zm Zp = Zm 2Zp < Zm 2Zp > Zm |
0 0 Zm 0 2Zp - Zm |
0 2Zp 0 2Zp 2(Zm - Zp) |
Zm 0 4 Zm - 2Zp 0 |
2Zp > Zm Z OH- = 2Zp - Zm = 4,19 [mval/dm3]
Z CO23- = 2 (Zm - Zp) = 37,34 [mval/dm3]
Z HCO3- = 0 [mval/dm3]
W badanej próbce wody znajduje się 4,19 [mval/dm3] jonów wodorotlenowych, 37,34 [mval/dm3] jonów węglanowych i 0 [mval/dm3] jonów wodorowęglanowych.
Zm
Zp
Wyszukiwarka
Podobne podstrony:
potencjometria, NAUKA, chemia, lab
POTENC~2, NAUKA, chemia, lab
Potencjometria P-1, NAUKA, chemia, lab
chemia10, NAUKA, chemia, lab
miareczkownie, NAUKA, chemia, lab
Równowaga w roztworach elektrolitów, NAUKA, chemia, lab
pat sciąga chemia zerówka, NAUKA, chemia, lab
Masa atomowa i cząsteczkowa, NAUKA, chemia, lab
Na ciała poruszające się w cieczy, NAUKA, chemia, lab
Oznaczenie miedzi, NAUKA, chemia, lab
grupy pierwsiatkow chemia, NAUKA, chemia, lab
adsorp, NAUKA, chemia, lab
chemia7, NAUKA, chemia, lab
chemia2, NAUKA, chemia, lab
Spektrofotometria S-3, NAUKA, chemia, lab
więcej podobnych podstron