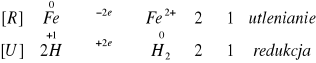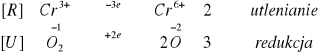Nr ćw. 10, 11 |
Data 21.04.2009r. |
Imię i Nazwisko Maria Szłapka |
Wydział Technologii Chemicznej |
Semestr II |
Grupa 9 Nr lab. V |
Prowadzący: |
Temat1: Reakcje utleniania i redukcji. Temat2: Reakcje utleniania i redukcji II. |
Ocena |
|||
Wstęp teoretyczny:
I.I. Reakcje redoks:
Jest to typ reakcji, który polega na wymianie elektronu pomiędzy czynnikiem redukującym (reduktorem), oddającym elektron, a czynnikiem utleniającym (utleniaczem), pobierającym elektron.
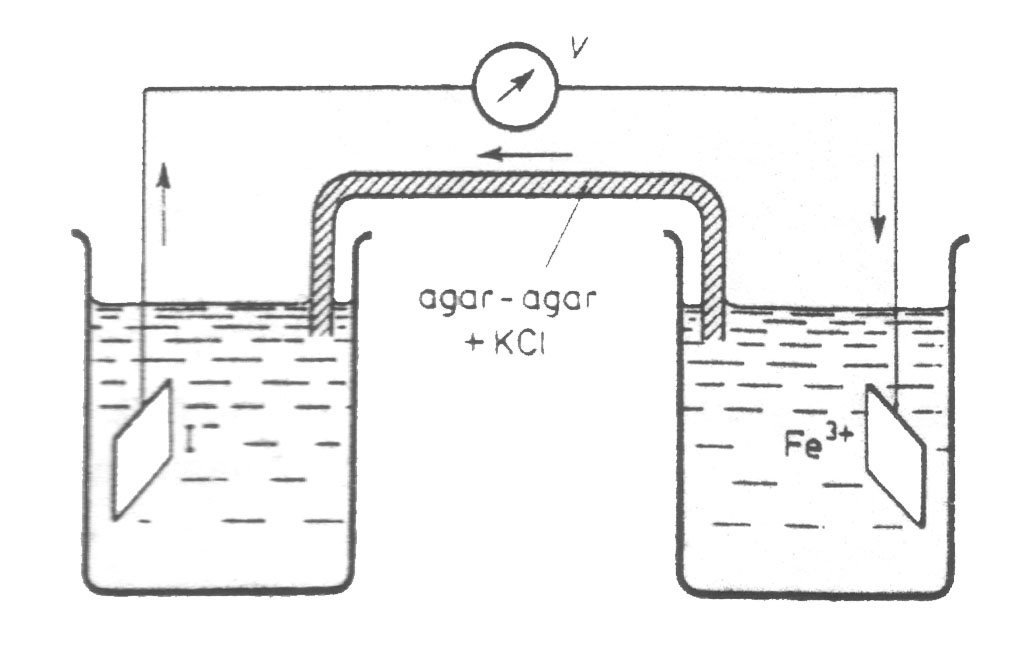
Przykładem może być ogniwo złożone z blaszek platynowych i roztworów jonów Fe3+ i I- , będących
w dwóch naczyniach połączonych mostkiem elektrolitycznym, zapewniającym przepływ elektronów
z jednego naczynia do drugiego. Następnie, gdy zamkniemy obwód roztwór jodków najpierw żółknie, następnie brązowieje.
W naczyniu z jonami jodkowymi przebiegła reakcja:
![]()
Zgodnie ze schematem:
reduktor 1 utleniacz 1 + ne
W naczyniu tym zaszła reakcja utleniania i polega ona na oddaniu elektronów. Sam jod jest w tym przypadku reduktorem.
W naczyniu z jonami żelaza zaszła reakcja:
![]()
Zgodnie ze schematem: utleniacz 2 + ne reduktor 2
W tej części układu zaszła reakcja redukcji (przejście jonów żelazowych w żelazawe), polegająca na pobraniu elektronów. Żelazo jest zatem utleniaczem.
Żadna z tych reakcji nie może istnieć osobno. Oba roztwory nie ulegają zmianom tak długo, dopóki są izolowane, dopiero po kontakcie tych dwóch części układu może zajść reakcja zgodna
z ogólnym schematem:
utleniacz 2 + reduktor 1 + ne reduktor 2 + utleniacz 1 + ne, czyli
utleniacz 2 + reduktor 1 reduktor 2 + utleniacz 1
I.II. Stopień utlenienia:
Stopniem utlenienia pierwiastka nazywamy liczbę dodatnich lub ujemnych ładunków elementarnych, które można by przypisać atomom tego pierwiastka, gdyby cząsteczki tej substancji miały budowę jonową. Suma stopni utlenienia wszystkich atomów wchodzących w skład cząsteczki obojętnej wynosi zero, natomiast wchodzących w skład jonu jest równa wartościowości jonu.
I.III. Potencjał redoks:
Potencjał redoks jest wielkością charakteryzującą dany układ pod względem jego właściwości redoks. Można go obliczyć ze wzoru Nernsta:
,
I.IV. Szereg napięciowy metali:
Szereg napięciowy metali prezentuje nam ułożone wartości potencjałów metali i wodoru (najczęściej od najmniejszego do największego).
-3,04V |
-2,9V |
-2,90V |
-2,86V |
-2,36V |
-1,75V |
-1,69V |
-1,40V |
-1,18V |
-0,76V |
-0,74V |
-0,44V |
-0,40V |
-0,28V |
-0,26V |
-0,14V |
-0,14V |
0V |
0,32V |
0,34V |
0,80V |
0,85V |
1,20V |
1,52V |
mogą wypierać wodór z kwasów nie wypierają wodoru z kwasów
Li K Ba Ca Mg Ti Al U Mn Zn Cr Fe Cd Co Ni Sn Pb H Bi Cu Ag Hg Pt Au
Wodór, którego potencjał jest umownie przyjęty jako 0V dzieli metale na dwie grupy: szlachetne(i półszlachetne) oraz metale nieszlachetne. Te pierwsze mają potencjał wyższy od potencjały wodoru i nie są w stanie wyprzeć wodoru z kwasu, w związku z czym są nierozpuszczalne w kwasach nieutleniających. Można je jedynie rozpuścić działając na nie silnymi utleniaczami. Z kolei metale leżące przed wodorem mają potencjał niższy od wodoru i są w stanie wyprzeć wodór z kwasu i one rozpuszczają się w kwasach beztlenowych.
I.V. Moc utleniacza i reduktora:
Najsilniejsze działanie utleniające wykazują jony metali o najwyższych potencjałach normalnych, np.: Au+, Au3+, Pt2+.
Najsilniejszymi środkami redukującymi są metale położone na początku szeregu napięciowego, wykazujące najbardziej ujemne potencjały normalne: Li, Rb, K, Cs, Ba itd.
Ważniejsze utleniacze: nadmanganian potasu, nadsiarczan amonowy, dwuchromian
i chromian potasowy lub sodowy, nadtlenek wodoru, podchloryn sodowy, bram, jod, chloramina T, nadjodan potasowy.Ważniejsze reduktory: sole chromowe (Cr2+), żelazawe (Fe2+), cynawe (Sn2+), tytanawe (Ti3+), siarczyny, azotyny, nadtlenek wodoru, hydroksyloamina, hydrazyna, kwas askorbinowy, kwas szczawiowy i kwas mrówkowy.
I.VI. Amfotery redoks:
Związki, które w zależności od tego czy reagują z silnym utleniaczem, czy z silnym reduktorem są albo reduktorami, albo w drugim przypadku utleniaczami nazywanymi amfoterami redoks. Są to najczęściej jony lub cząsteczki zawierające pierwiastki na pośrednim stopniu utlenienia (np.: Mn(IV)
i Mn(VI), bowiem występują na pośrednim stopniu utlenienia, mogą zatem obniżyć swój stopień utlenienia lub podwyższyć go).
I.VII. Woda utleniona jako utleniacz oraz reduktor w reakcjach redoks:
Jest to typowy amfoter redoks, stosowany częściej jako utleniacz. Jest wygodny
w stosowaniu, bowiem nie powoduje wprowadzenia żadnego dodatkowego jonu do badanego roztworu. Nadmiar nadtlenku wodoru rozkłada się łatwo przez wygotowanie , wydziela się przy tym tlen, zgodnie z reakcją: ![]()
. 30 % roztwór ![]()
zwany jest perhydrolem i w tej postaci nadtlenek wodoru jest przechowywany. Przy dłuższym przechowywaniu zachodzi rozkład tej substancji.
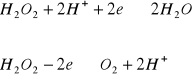
W reakcjach z reduktorami nadtlenek wodoru reaguje według pierwszego równania, np. z jonami jodkowymi:
![]()
(H2O2 jako utleniacz)
W reakcjach z utleniaczami nadtlenek wodoru działa jak reduktor np.:
![]()
(H2O2 jako reduktor)
Temat1: Reakcje utleniania i redukcji I.
Przebieg doświadczenia:
II.I. Redukcja przez metal:
Na blaszki: miedziową, cynową i glinową nanosiliśmy przy pomocy pipet kapilarnych po jednej kropli następujących soli: Hg2+, Hg2+2, Ag+, Cu2+, Bi3+, Zn2+. Po kilku minutach przemyliśmy blaszki wodą destylowaną. Zaobserwowaliśmy następujące zabarwienia płytki:
II.I.I. Blaszka miedziowa (przemyta wodą utlenioną posiada ECu = 0,34 V):
Hg2+ biały; potencjał normalny +0,85V > ECu
Hg22+ żółtozielony; potencjał normalny +0,79V > ECu
Ag2+ ciemnozielony; potencjał normalny +0, 80V > ECu
Cu2+ miedziany ; potencjał normalny +0,34V
Bi2+ różowy; potencjał normalny +0,20V < ECu
Zn2+ kremowy; potencjał normalny -0,76 < ECu
Zachodzące reakcje:
![]()
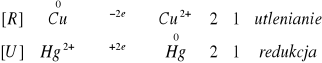
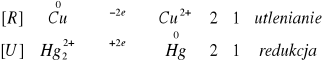
![]()
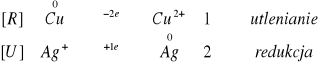
nie zajdzie reakcja
![]()
nie zajdzie reakcja
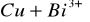
nie zajdzie reakcja
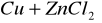
nie zajdzie reakcja
![]()
nie zajdzie reakcja
Zabarwienie w przypadku jonów Cu2+, Bi3+, Zn2+ mogło pojawić się na skutek niedoczyszczenia blaszki. Zgodnie z szeregiem napięciowym metali, reakcje te nie zachodzą.
II.I.II. Blaszka cynowa (przemyta wodą utlenioną posiada ESn = -0,14 V):
Hg2+ czarny; potencjał normalny +0,85V > ESn
Hg22+ żółty; potencjał normalny +0,79V > ESn
Ag2+ czarny; potencjał normalny +0,80V > ESn
Cu2+ brązowy; potencjał normalny +0,34V > ESn
Bi2+ niebieski; potencjał normalny +0,20V > ESn
Zn2+ brak; potencjał normalny -0,76V > ESn
Zachodzące reakcje:
![]()
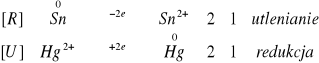
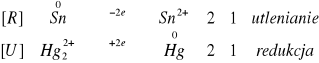
![]()
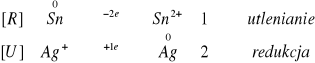
![]()
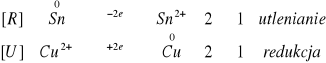
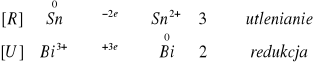
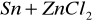
nie zajdzie reakcja
![]()
nie zajdzie reakcja
Zabarwienie w przypadku jonów Zn2+ mogło pojawić się na skutek niedoczyszczenia blaszki. Zgodnie
z szeregiem napięciowym metali, reakcje te nie zachodzą.
II.I.III. Blaszka glinowa przemyta wodą utlenioną posiada EAl = -1,66 V):
Hg2+ biały; potencjał normalny +0,85V > EAl
Hg22+ brak; potencjał normalny +0,79V > EAl
Ag2+ żółty; potencjał normalny +0,80V > EAl
Cu2+ bordowy; potencjał normalny +0,34V > EAl
Bi2+ ciemnoszary; potencjał normalny +0,20V > EAl
Zn2+ szary; potencjał normalny -0,76V > EAl
Zachodzące reakcje:
![]()
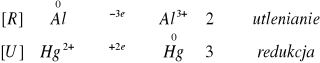
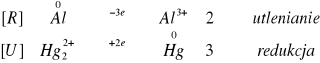
![]()
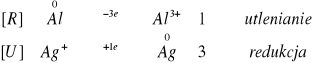
![]()
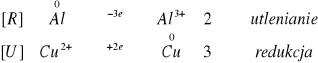
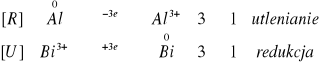
![]()
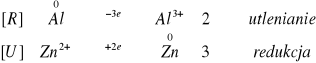
II.II. Własności utleniające jonów wodorowych:
II.II.I. W czterech probówkach umieściliśmy po jednym opiłku żelaza, glinu, cynku i magnezu. Następnie dodaliśmy około 2cm3 stężonego kwasu solnego.
HCl
Fe II. Al III. Zn IV. Mg
We wszystkich probówkach nastąpiło wydzielanie się wodoru. W probówkach III i IV reakcja zaszła samorzutnie, natomiast, aby zaobserwować wydzielanie H2 w probówkach I i II musieliśmy podgrzać badane próby palnikiem gazowym. W przypadku probówki z opiłkiem żelaza reakcja zachodziła z najmniejsza intensywnością. Najbardziej efektownie reagował magnez. Z czasem zaczęła przebiegać gwałtowna reakcja, wytwarzając „piana” świadcząca o rozpuszczaniu magnezu. We wszystkich tych reakcjach metale użyte w doświadczeniu wypierały wodór z kwasu beztlenowego.
Zachodzące reakcje:
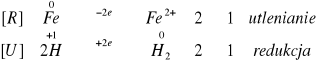
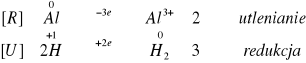
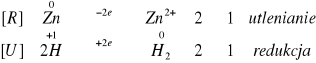
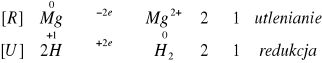
II.II.II. W czterech probówkach umieściliśmy po jednym opiłku żelaza, glinu, cynku i magnezu. Następnie dodaliśmy około 2cm3 6M NaOH.
NaOH
Fe II. Al III. Zn IV. Mg
Po dodaniu NaOH również zaobserwowaliśmy wydzielanie się wodoru w probówkach. Reakcje zachodziły wolniej niż w przypadku dodawania HCl. Reakcja z magnezem nie zachodzi.
Zachodzące reakcje:
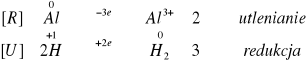
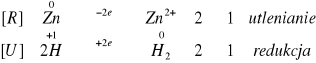
Reakcja nie zaszła
II.III. Moc utleniaczy i reduktorów - przewidywanie reakcji redoks.
II.III.I. Do probówki z 2cm3 roztworu Na2SO3 dodaliśmy kilka kropel żółtawego 0,01M jodku potasu J3-. Zaobserwowaliśmy odbarwienie roztworu.
![]()
II.III.II. Do probówki z 2cm3 roztworu NaNO2 dodaliśmy kilka kropel 2M HCl oraz KI. Po dodaniu skrobi zaobserwowaliśmy fioletowo-niebieskie zabarwienie, które świadczy o obecności jodu. Wcześniej roztwór był bezbarwny.
![]()
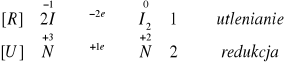
gdzie:
- potencjały reagentów, n1,n2 - ładunki reagentów
II.IV. Wpływ temperatury na kierunek reakcji redoks.
II.IV.I. Do ok. 2cm3 0,1M szczawianu amonu ( o wzorze: [(NH4)2C2O4]) dodaliśmy kilka kropel 2M H2SO4. Po dodaniu kwasu siarkowego nie zaobserwowaliśmy żadnych widocznych zmian (roztwór nadal był bezbarwny). Następnie po dodaniu 0,01M KMnO4 roztwór zabarwił się na fioletowo. Po jakimś czasie roztwór odbarwia się.
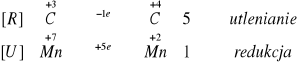
II.IV.II. Przyrządziliśmy taką samą próbę jak w pkt II.IV.I. i następnie ogrzaliśmy ją nad palnikiem gazowym . Zaobserwowaliśmy odbarwienie roztworu- szybsze niż w pkt II.IV.I.
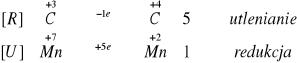
II.IV.III. Do 1cm3 6% H2O2 dodaliśmy kilka kropel 2M NaOH oraz kilka kropli soli Cr3+. Roztwór zabarwił się na jasnożółty. Po dodaniu Pb2+ nastąpiła gwałtowna reakcja i zaobserwowaliśmy pojawienie się pomarańczowego osadu. W drugiej probówce, którą ogrzewaliśmy, schłodziliśmy,
a następnie dodaliśmy Pb2+ również zaobserwowaliśmy pojawienie się pomarańczowego osadu
II.IV.IV. Do probówki wsypaliśmy niewielką ilość stałego PbO2, dodaliśmy 2cm3 2M HNO3 i kilka kropel roztworu jonów Mn2+. Zaobserwowaliśmy brązowo-popielaty kolor osadu. Takie zabarwienie osadu świadczy o obecności manganu na +IV stopniu utlenienia. Mangan w tej reakcji zmieniał swój stopień utlenienia z +II na + IV.
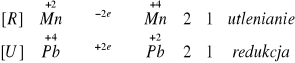
III. Opracowywanie wyników:
III.I. Potencjały normalne:
Reakcje na blaszkach: miedziowej, cynowej i glinowej zachodzą tam, gdzie potencjał czystego metalu ( w postaci blaszki) jest niższy od potencjału metalu znajdującego się w roztworze, tzn. metale o potencjale niższym mogą wypierać metale o potencjale wyższym z roztworów.
Kierunek reakcji zależy od umiejscowienia metalu w szeregu napięciowym (od jego potencjału). Zawsze metal, który ma potencjał niższy wypiera z roztworu ten o potencjale wyższym.
III.II. Wydzielanie wodoru podczas reakcji metalu w środowisku kwaśnym lub zasadowym:
Wydzielanie wodoru w reakcji metali z kwasem solnym należy tłumaczyć położeniem ich
w szeregu napięciowym. Wodór w tym przypadku miał potencjał wyższy niż wszystkie metale biorące udział w doświadczeniu. Mógł on być dlatego wypierany z kwasu przez metale
o potencjałach niższych.W przypadku reakcji w środowisku zasadowym ( podczas dodawania NaOH) reakcje zachodziły tylko tam, gdzie brały udział metale będące amfoterami. W reakcjach tych powstawały związki kompleksowe i następowało wydzielanie wodoru. W przypadku opiłku magnezu reakcja nie zaszła, gdyż nie wykazuje on właściwości amfoterycznych.
III.III. Obliczanie stałych równowagi dla wykonanych reakcji redoks:
Do obliczenia wykorzystujemy wzór:
![]()
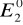
i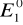
to potencjały normalnen1 i n2 to liczba elektronów biorących udział w reakcji utleniania i redukcji
Tabela 1 Obliczanie stałych równowagi reakcji redoks
Jon |
Obliczanie stałej równowagi (blaszka miedziowa) |
Obliczanie stałej równowagi (blaszka cynowa) |
Obliczanie stałej równowagi (blaszka glinowa) |
Hg2+ |
=34,6
|
��������=��1−��2��1∙��20,059 =67,1 ��=��������,��≈��,����∙�������� |
��������=��1−��2��1∙��20,059 =255,25
|
Hg22+ |
=30,5
|
��������=��1−��2��1∙��20,059 =63,05 ��=��������,����≈��,����∙�������� |
��������=��1−��2��1∙��20,059 =249,15
|
Ag+ |
=15,6
|
��������=��1−��2��1∙��20,059 =31,9 ��=��������,��≈��,����∙�������� |
��������=��1−��2��1∙��20,059 =125,1
|
Cu2+ |
|
��������=��1−��2��1∙��20,059 =32,5 ��=��������,��≈��,����∙��������
|
��������=��1−��2��1∙��20,059 =203,4
|
Bi3+ |
|
��������=��1−��2��1∙��20,059 =34,6 ��=��������,��≈��∙�������� |
��������=��1−��2��1∙��20,059 =283,7
|
Zn2+ |
|
|
��������=��1−��2��1∙��20,059 =91,5 ��=��������,��≈��,����∙�������� |
III.IV. Różnice w szybkości reakcji w zależności wynikające ze zmian temperatury:
W czasie podgrzewanie probówek obserwujemy przyspieszenie reakcji pod wpływem temperatury.
Odbarwienie roztworu, który został podgrzany nastąpiło szybciej niż w przypadku, gdy roztwór znajdował się w temperaturze pokojowej (pkt II.IV.)
Chrom szybciej zmienia swój stopień utlenienia, gdyż pod wpływem temperatury substraty szybciej ze sobą reagują.
Podwyższając temperaturę mogliśmy również zaobserwować wydzielanie oparów amoniaku.
IV. Wnioski:
Jony metali o niższym potencjale wypierają w reakcji te o wyższym potencjale standardowym. Metal położony wyżej w szeregu napięciowym jest wypierany z roztworu przez metal położony niżej (np.: cynk wypiera z roztworu miedź, ale sam może zostać wyparty przez glin).
W przypadku reakcji na blaszkach obserwowaliśmy pojawienie się różnych kolorów mimo iż
z szeregu napięciowego wynika, że reakcje te nie mogą zajść. Przyczyn należy dopatrywać się np.:
w niedokładności czyszczenia blaszek. Wielokrotne użytkowanie tych samych blaszek
w doświadczeniach mogło zakłócić przebieg reakcji.Metale używane przez nas w doświadczeniu opisanym w pkt. II.II. mają potencjał wyższy od potencjału wodoru dlatego reagują z kwasem solnym (czasem nawet gwałtownie). W przypadku środowiska zasadowego reakcje zachodzą tylko i wyłącznie, gdy używamy metali wykazujących właściwości amfoteryczne.
Podgrzewanie badanych próbek ma wpływ na reakcje erdoks.
Pierwiastki zmieniające swój stopień utlenienia zmieniają również barwę (np. chrom, mangan).
Temat2: Reakcje utleniania i redukcji II.
Przebieg doświadczenia:
II.I. Zmiany pH podczas reakcji redoks:
II.I.I. Do probówki napełnionej ok. 2cm3 0,1M KIO3, dodaliśmy kroplę oranżu metylowego a także 0,1M HCl w celu uzyskania czerwonej barwy wskaźnika. W drugiej probówce zakwasiliśmy dodatkowo środowisko przy pomocy 0,1M HCl i 0,1M Na2S2O3. KIO3 w obecności oranżu metylowego zabarwiło się na pomarańczowo, a po dodaniu 3 kropel HCl przeszedł w kolor czerwony. Na2S2O3 po dodaniu oranżu metylowego i HCl zabarwił się na również na kolor czerwony. Po zmieszaniu zawartości obu probówek roztwór zabarwił się na pomarańczowo.
Zachodzące reakcje:
8 KIO3 + 5 Na2S2O3 + 8 HCl + H2O 4 I2 + 10 NaHSO4 + 8 KCl
I5+ + 5 ē I2 |x 8
S2+ S6+ + 4 ē |x 10
II.I.II. Na płytce porcelanowej zmieszaliśmy kilka kropli roztworu zawierającego jony SO32-
a także 0,01M jodku potasu. Papierek uniwersalny zabarwił się na brązowo.
Zachodzące reakcje:
SO32- + I2 + H2O SO42- + 2 I- + 2 H+
S4+ + 2 ē S6+
I2 2 I- + 2 ē
II.II. Przewidywanie kierunku reakcji w zależności od pH:
II.II.I. Do probówki wypełnionej ok. 2cm3 6% H2O2 dodaliśmy 2 krople 2M H2SO4, a także 0,01M jodek potasu. Roztwór, który był bezbarwny po dodaniu jodu zmienił swoje zabarwienie na ciemnopomarańczowe. W momencie, gdy dodaliśmy 2M NH3 w celu zalkalizowania środowiska reakcji zaobserwowaliśmy odbarwienie roztworu.
Zachodzące reakcje:
5 H2O2 + I2 2 IO3- + 2 H+ + 4 H2O
O- + ē O2- |x 10
I2 2 I5+ + 10 ē |x 1
II.II.II. Do trzech probówek wprowadziliśmy odpowiednio:
KMnO4 + Na2S2O3
1cm3 2M H2SO4 II. 1cm3 2M NaOH III. Środowisko obojętne
Odbarwienie roztworu, pojawiła się mętna zawiesina
Zielonkawy kolor
Brunatne zabarwienie
Zachodzące reakcje:
8 KMnO4 + 12 H2SO4 + 5 Na2S2O3 8 MnSO4 + 4 K2SO4 + 10 NaHSO4 + 7 H2O
[U] Mn7+ + 5 ē Mn2+ |x 8
[R] S2+ S6+ + 8 ē |x 10
8 KMnO4 + 7 H2O + 3 Na2S2O3 8 MnO2 + 6 NaHSO4 + 8 KOH
[U] Mn7+ + 3 ē Mn4+ |x 8
[R] S2+ S6+ + 8 ē |x 6
8 KMnO4 + 8 KOH + Na2S2O3 8 K2MnO4 + 2 NaHSO4 + 3 H2O
[U] Mn7+ + 1 ē Mn6+ |x 8
[R] S2+ S6+ + 8 ē |x 2
II.II.III. Do probówki z ok. 2cm3 NaCl dodaliśmy 2 krople H2SO4 oraz jony chloranowe w postaci KClO3. Zaobserwowaliśmy różowo-czerwone zabarwienie papierka wskaźnikowego.
II.II.IV. Do probówki z ok. 2cm3 KIO3 dodaliśmy 2 krople H2SO4 oraz jony jodkowe. Zaobserwowaliśmy pojawienie się koloru brązowego. Po dodaniu do badanej próby skrobi pojawia się charakterystyczne fioletowo-granatowe zabarwienie, świadczące o obecności jodu w badanej próbie.
Zachodzące reakcje:
IO3- + 5 I- + 6 H+ 3 I2 + 3 H2O
I- I0 + ē |x 5
I5+ + 5 ē I0 |x 1
II.III. Dysproporcjonacja pod wpływem pH:
Do probówki z jodem dodaliśmy 2cm3 2M NaOH i zaobserwowaliśmy zmianę barwy roztworu z czerwonego na bardzo jasno zielony.
II.IV. Wpływ pH na utlenianie chlorków:
II.IV.I. Do 2cm3 roztworu chlorków dodaliśmy kilka kropel 2M H2SO4 i 2cm3 0,01M KMnO4. Po ogrzaniu zaobserwowaliśmy pojawienie się fioletowej barwy w przypadku KMnO4. Roztwór z kwasem siarkowym VI był bezbarwny. Papierek jodoskrobiowy zabarwił się na brązowo.
Zachodzące reakcje:
2 KMnO4 + 8 H2SO4 + 10 KCl 2 MnSO4 + 6 K2SO4 + 5 Cl2 + 8 H2O
[U] Mn7+ + 5 ē Mn2+ |x 2 E = 1,52 V
[R] Cl- Cl0 + ē |x 10 E = 1,34 V
II.IV.II. Do 2cm3 NaCl dodaliśmy kilka kropel 2M HNO3 oraz odrobinę PbO2. Po ogrzaniu sprawdziliśmy obecność chloru przy pomocy papierka jodoskrobiowego, który zabarwił się na kolor brunatno-czarny.
Zachodzące reakcje:
2 NaCl + 2 HNO3 + PbO2 Cl2 + PbO + 2 NaNO3 + H2O
[R] Cl- Cl0 + ē |x 2 E = 1,34 V
[U] Pb4+ + 2 ē Pb2+ |x 1 E = 1,46 V
II.IV.III. Próbę wykonaliśmy jak wyżej, stosując jedynie jako utleniacza di tlenek manganu. Roztwór ten miał czarne zabarwienie, natomiast papierek jodoskrobiowy zabarwił się w nim na kolor brunatny.
Zachodzące reakcje:
2 NaCl + 2 HNO3 + MnO2 reakcja nie zachodzi
[R] Cl- Cl0 + ē |x 2 E = 1,34 V
[U] Mn4+ + 2 ē Mn2+ |x 1 E = 1,28 V
Reakcja nie zachodzi, gdyż potencjał utleniacza jest mniejszy od potencjału reduktora.
III. Opracowywanie wyników:
l.p. |
utleniacz |
E utleniacza w środowisku |
Obecność chloru w parach |
||
|
|
Obojętne |
Kwaśne |
Obojętne |
Kwaśne |
1 |
KMnO4 |
0,57 V |
1,52 V |
brak |
Obecny |
2 |
PbO2 |
1,46 V |
1,46 V |
Brak |
Obecny |
3 |
MnO2 |
1,69 V |
1,28 V |
Brak |
Obecny |
Wykres zależności potencjału od pH:
E[V]
E0(Cl) = 1,36 V
E0(Br) = 1,09 V E = E0 - 0,059· pH
E0(I) = 0,54 V
Wnioski:
Jony metali o niższym potencjale wypierają w reakcji te o wyższym potencjale standardowym. Metal położony wyżej w szeregu napięciowym jest wypierany z roztworu przez metal położony niżej (np.: cynk wypiera z roztworu miedź, ale sam może zostać wyparty przez glin).
Reakcja zachodzi, gdy pierwiastek o wyższym potencjale jest utleniaczem.
Reakcje redoks zawsze zachodzą jednocześnie, nie istnieją oddzielnie, są nierozerwalne. Temperatura ma wpływ na reakcje utleniania-redukcji. Im wyższe pH tym równowaga reakcji jest przesunięta bardziej w prawo. Reakcja może zajść tylko wtedy gdy potencjał reduktora jest mniejszy od potencjału utleniacza.
(utleniacz)
(reduktor)
Wyszukiwarka
Podobne podstrony:
5335
5335
5335
5335
5335
5335
5335
5335
więcej podobnych podstron