 | Pobierz cały dokument w.zwiazki.karbonylowe.cz.ii.podstawy.chemii.doc Rozmiar 804 KB |
14b. Związki karbonylowe
2009 wrzesień
14.11.8 Reakcje kondensacji
Kondensacja aldolowa
Aldehydy i ketony zawierające atom wodoru przy C ulegają kondensacji katalizowanej przez zasady i kwasy. W reakcji tej powstają dimery - aldehydoalkohole, dlatego została ona nazwana kondensacją aldolową a produkt dimeryzacji etanalu zwany jest aldolem.
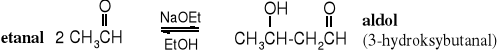
Reakcja kondensacji aldolowej jest odracalna, przy czym dla monopodstawionych aldehydów (RCH2CHO) równowaga jest przesunięta na prawo, zaś dla rozgałęzionych aldehydów i większości ketonów na lewo. Z aldehydami biegnie ona z zadawalającą szybkością. Zwykle w warunkach reakcji tworzą się nienasycone aldehydy lub ketony, jako że w warunkach reakcji dochodzi do eliminacji cząsteczki wody z produktów; -podstawione aldehydy i ketony są bardzo podatne na eliminację. Dehydratacja ułatwia reakcję, ponieważ powoduje przesunięcie równowagi reakcji w kierunku dimerów.
Omawiana reakcja nosi nazwę kondensacji, a nie dimeryzacji, z powodu podatności aldoli do dehydratacji. Kondensacja bowiem to reakcja dimeryzacji (oligomeryzacji lub polimeryzacji), w której obok głównego produktu wydzielają się małe cząsteczki - w tym wypadku wody.
Mechanizm reakcji
Kondensacja aldolowa polega na addycji nukleofilowej do karbonylowego atomu węgla anionu powstałego w wyniku oderwania protonu z C.
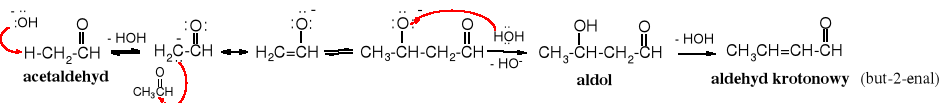
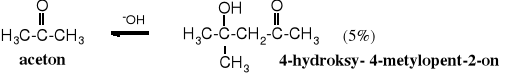
Podobnie wygląda kondensacja aldolowa acetonu, jednak wydajność tej reakcji jest niska.
Mechanizm reakcji
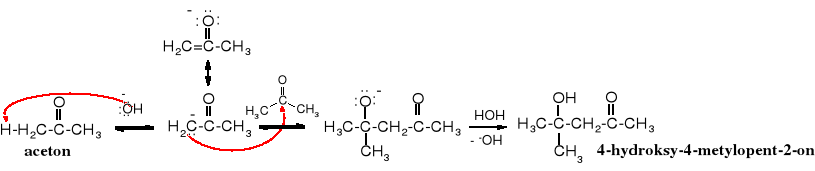
Wydajność kondensacji aldolowej acetonu można zwiększyć przez usuwanie produktu ze środowiska reakcji, tzn. oddzielając go od alkalicznego katalizatora. Kiedy reakcję prowadzi się w kolumnie wypełnionej kawałkami Ba(OH)2 aceton skrapla się w chłodnicy zwrotnej, przepływa przez kolumnę, gdzie w zetknięciu z Ba(OH)2 ulega częściowej dimeryzacji i spływa do kolby zawierając kilka procent 4-hydroksy-4-metylopentan-2-onu. Aceton w kolbie ciągle wrze, a jego pary skraplając się w chłodnicy zwrotnej przepływają przez kolumnę z Ba(OH)2 i ulegają dalszej dimeryzacji. Ten proces trwa aż do wyczerpania acetonu, a w kolbie pozostaje prawie czysty produkt dimeryzacji.
W cykloheksanonie zawada przestrzenna jest mniejsza niż w acetonie (sztywny układ) i dzięki temu wydajność jego dimeryzacji jest kilka razy większa (22%).
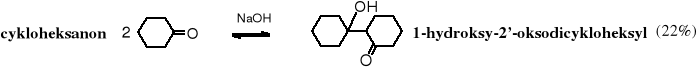
Kondensację aldolową stosuje się często w syntezie różnorodnych związków organicznych, zarówno w laboratorium, jak i w skali technicznej. Powstające w reakcji aldole można poddawać dehydratacji, dalszej kondensacji aldolowej lub selektywnej redukcji.
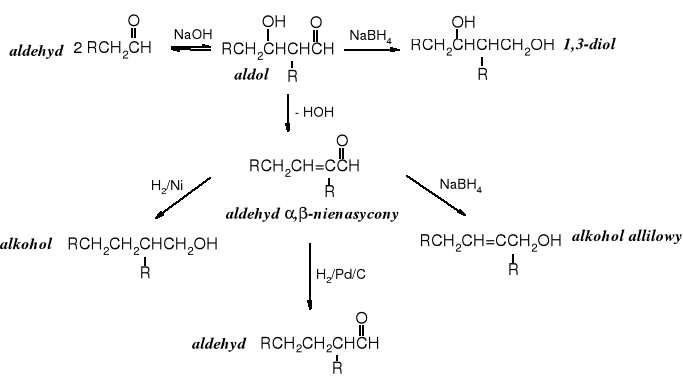
Kondensacja aldolowa jest szeroko stosowana w przemyśle, szczególnie do otrzymywania alkoholi. Tą drogą produkuje się butan-1-ol.
 | Pobierz cały dokument w.zwiazki.karbonylowe.cz.ii.podstawy.chemii.doc rozmiar 804 KB |