02 (126)

Plik I G/ ISA S'i i-.
3. Przy stwierdzeniach, odnoszących się do przedstawionego niżej schematu przemian odwracalnych I mola gazu doskona
tego, wpisz które są prawdziwej a które fałszywe; i
1 '/i pkt możliwe do uzyskania, po /• pkl za każdą dobrą odpowiedź, po -'/> pkt za zlą. za brak odpowiedzi 0 pkt
a) jeśli AH,.2=0 to T, > T, P
3 2
b) jeśli AH,.2=0 to qn=w,.;
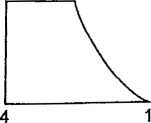
c) ASrn-t r’0
d) AH,_i=qi.:
e) AH2.3=<l2-3
0 ah,+3=ah,.2.}
g)
V
4. Wpisz, które stwierdzenia dotyczące termochemii są prawdziwe, a które fałszywe:
2 pkt możliwe do uzyskania; po Vi pkt za każdą dobrą odpowiedź, po - - s/z pkt za złą za brak odpowiedzi 0 pkt.
a) standardowe molowe entalpie tworzenia siarki jednoskośnej i siarki rombowej są sobie równe
b) standardowa entalpia pierwiastka w formie trwalej w temperaturze 298 K pod ciśnieniem standardowym zależy
od masy molowej pierwiastka
c) molowe ciepło reakcji CHłjg) + 02(g) = 2H2(g) + C02(g) pod stałym ciśnieniem jest równe molowemu ciepłu tej reakcji w warunkach izochorycznych
d) prawo Hessa ma zastosowanie wyłącznie do entalpii standardowych w temperaturze 298K
5. Wpisz, które stwierdzenia dotyczące entropii i II zasady termodynamiki są prawdziwe, a które fałszywe:
2 pkt możliwe do uzyskania; po '/: pkt za każdą dobrą odpowiedź, po -Z: pkt za zlą, za brak odpowiedzi 0 nkt
a) entropia jest ekstensywną funkcją stanu
b) ciepło nigdy nie może przepływać od ciała o temperaturze niższej do ciała o temperaturze wyższej
c) entropia układu podczas przebiegającej w nim samorzutnie reakcji chemicznej może maleć
d) entropia 1 grama lodu jest mniejsza niż entropia 1 grama wody w tych samych warunkach P i T
6. Entalpię (zmianę entalpii) układu często określa się jako ciepło wymieniane przez układ pod stałym ciśnieniem (pochodna (dH/dT)p=Cp). Czy oznacza to, że: (napisz PRAWDA lub FAŁSZ)
2 pkt możliwe do uzyskania; Zi pkt za każdą dobrą odpowiedź, -'A pkl za zlą za brak odpowiedzi 0 pkt
a) procesy przebiegające w warunkach stałej objętości nie prowadzą do zmiany entalpii układu
b) zmiana entalpii nigdy nie może być równa zmianie energii wewnętrznej
c) entalpia zmienia się w każdym procesie (poza izoentalpowymi) lecz jedynie w procesach prowadzonych w warunkach izobarycznych można ją utożsamić z wymienianym ciepłem
d) w procesach izoentalpowych nigdy nie dochodzi do zmiany temperatury układu
Przedstaw najprostszy dowód na konieczność istnienia temperatury zera bezwzględnego: I pkt możliwe do uzyskania; nie ma punktów uiemmcfT
Wyszukiwarka
Podobne podstrony:
Plik:EGZ_15A_89.doc Przy stwierdzeniach, odnoszących się do przedstawionego niżej schematu przemian
02 (124) /~ Egz_IC_.34.DCX; /3. Przy stwierdzeniach, odnoszących się do przedstawi
skanuj0006 Powodzenia! 1. Przy stwierdzeniach, odnoszących stę do przedstawionego niżej schematu prz
3 tóre ze stwierdzeń odnoszących się do jelita grubego jest/są błędne ? — 1. ISA Okrężnica esowata
Zadanie 1. (o-i) Oceń prawdziwość poniższych stwierdzeń odnoszących się do przemówienia Włodzimierza
Zadanie 1. (0-1) Oceń prawdziwość poniższych stwierdzeń odnoszących się do przemówienia Włodzimierza
więcej podobnych podstron