1530299é8324687194667v115551 n

refrakcji obliczonej dla danego, proponowanego wzoru strukturalnego z refrakcj─ů wyznaczon─ů do┼Ťwiadczalnie jest wa┼╝nym potwierdzeniem proponowanej struktury. Je┼╝eli refrakcja molowa otrzymana z zasady addytywno┼Ťci nie zgadza si─Ö z refrakcj─ů otrzyman─ů na podstawie wzoru (1). w├│wczas ┼Ťwiadczy to o zale┼╝no┼Ťci wi─ůza┼ä w cz─ůsteczce. R├│┼╝nica refrakcji otrzymana tymi dwoma metodami nazywa si─Ö egzaltacj─ů refrakcji, i jest ona miar─ů si┼éy oddzia┼éywania pomi─Ödzy elektronami z r├│┼╝nych wi─ůza┼ä.
Zasada addytywno┼Ťci refrakcji obowi─ůzuje r├│wnie┼╝ w przypadku mieszaniny kilku substancji. Refrakcja mieszaniny R wynosi:
R = ZXiR, (4)
i
gdzie R. jest refrakcj─ů i - tego sk┼éadnika mieszaniny, a X, oznacza u┼éamek molowy i - tego sk┼éadnika. Przyk┼éadowo - dla wodnego roztworu alkoholu - refrakcja roztworu:
R = XaRa+XÔÇ×RÔÇ× (5)
gdzie Ra i R* oznaczaj─ů, odpowiednio, refrakcje molowe alkoholu i wody. a Xa i Xw odpowiednie u┼éamki molowe. Je┼╝eli przez iha i mw oznaczymy odpowiednio masy alkoholu i wody w roztworze, w├│wczas st─Ö┼╝enie wagowe alkoholu w roztworze mo┼╝na wyrazi─ç albo w procentach: p% = mA/(mA + mw)-100% albo w u┼éamku: p = niA/(mA + mw). Korzystaj─ůc z definicji u┼éamka molowego (np. u┼éamek molowy alkoholu XA = NA/(NA + Nw), gdzie NA i Nw oznaczaj─ů, odpowiednio, liczby moli alkoholu i wody) mo┼╝na ┼éatwo pokaza─ç, ┼╝e u┼éamek molowy alkoholu jest zwi─ůzany ze st─Ö┼╝eniem wyra┼╝onym w u┼éamku zale┼╝no┼Ťci─ů:
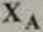
PMW
Ma-P(Ma-Mw)

gdzie Ma i Mw oznaczaj─ů, odpowiednio, masy molowe alkoholu i wody. Poniewa┼╝ suma u┼éamk├│w molowych wszystkich sk┼éadnik├│w roztworu jest r├│wna jeden, wi─Öc u┼éamek molowy wody: Xw = 1 - XA.
Wyszukiwarka
Podobne podstrony:
Wrzenie w rurach: aÔÇ× 1 4┬źu + a, **. -a, gdzie: aw - obliczone dla danego At w du┼╝ej obj─Öto┼Ťci; au -
WYKŁAD ALGORYTM ITERACYJNY Oblicz n! dla zadanego n według wzoru fi dlan = 0n! = i ll*2*3*...*(n-l)*
img038 (28) badaniu jest dopuszczalne po ka┼╝dorazowym ustaleniu dla danego betonu poprawek AL wg wzo
strona (80) nale┼╝y dla niej obliczy─ç MED, korzystaj─ůc ze wzoru (1), gdzie D = odleg┼éo┼Ť─ç sk├│ry od pal
skanuj0007(1) 4 4. Obliczenia i dob├│r d┼éugo┼Ťci ┼Ťruby oczkowej ÔÇ× I ÔÇŁ dla danego skoku naci─ůgu linoweg
b) Na podstawie wzoru (5) obliczy─ç dla pi─Öciu warto┼Ťci nat─Ö┼╝enia pr─ůdu wirowego po sze┼Ť─ç warto┼Ť
5. Obliczy─ç wielko┼Ťci d korzystaj─ůc ze wzoru: d = zm [mm] 6. Dla
2. R├│wnania r├│wnowagi dla dowolnego, odkszta┼éconego fragmentu struktury: Reakcje obliczymy bior─ůc po
27898 skanuj0003 (351) 4. Obliczenia i dob├│r d┼éugo┼Ťci ┼Ťruby oczkow─Öj ÔÇ× i ÔÇŁ dla danego skoku naci─ůgu
wi─Öcej podobnych podstron