arkusz bII + odpowiedzi0007

Za interpretację równania CO<B) + HaOw
|
stężenia reagentów (mol-dm-3) |
cco r>i,o Qo. f\\ |
|
stan początkowy |
2 3 0 0 |
|
stan równowagi |
2-x 3-x x x |
Za podanie wyrażenia na stałą równowagi K _ cn,'c< o, f co ‘ {j 1,0
Za obliczenie stężenia produktów reakcji w sianie równowagi
1
x*x
—x = 1,2 mol • dm ;
(2 - x)(3 - x)'
Za obliczenie -.tężenia substratów w sianie równowagi Cco = 2 - 1,2 = 0,8 mol - dm ; c)l o - .i - 1,2 = 1,8 mol-dm !
7. • Za ułożenie równań w formie cząsteczkowej i jonowej skróconej dwóch pierwszych reakcji po 1 pkl
I CrC:ii + 3NaOH — Cr(OH), + 3NaCI
Cr3* + 3 OH" — Cr(OH),
II Cr(OH), + NaOI 1 —♦ Na[Cr{OH)J Cr(OH), + OH —* |Cr(OH)J-
Za ułożenie równania redoks
III 2Na(Cr(OH)4| + 2NaOH + 3H.O. —- 2Na7Cr04 + 8H,C)
2[Cr(OH)J a 2OH + 3H.O —*- 2CrOŚ + 8H.O
8. • Za podanie wzorów elektrolitów w elektrolizerzc A i B po 1 pkt A — kwas tlenowy lub sól kwasu tlenowego i metalu reaktywnego lub
wodorotlenek reaktywnego metalu, B — CuCI2 Za podanie elektrolitu w clektrolizerze C CH-jCOONa lub CH,COOH
9. • Za przedstawienie schematu przemian
2x1
2x1
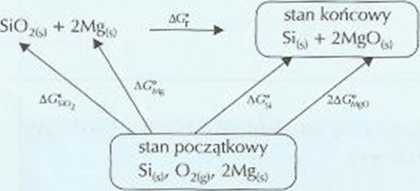
Za obliczenie AC?
AGI*, 4- AG? = 2 • AG^go AC? = 2AC^0 - AG®io ; AC? = -281,9 kj Za sformułowanie odpowiedzi
ujemna wartość entalpii swobodnej wskazuje, że w podanych warunkach reakcja zachodzi
10.
Za ułożenie każdego równania po 1 pkt
HCI + H.O —- HjCT + CV; Nil, + H2Q
kw. 1 7.iv. kw. 2 zav. 1 z&>. I kw. 2
Za określenie roli wody
kwas lub zasada zależnie- od warunków
: NHj + OH"
kw. I 7.1S. 2
2x1
44
Wyszukiwarka
Podobne podstrony:
arkusz bII + odpowiedzi0009 1 2 3 4 17. Za podanie równań czterech reakc ji po i pkt (przyjmuje się
arkusz dII + odpowiedzi0007 ^2 10. Za napisanie równania kinetycznego przy zwiększonym x-krotnie ciś
arkusz bII + odpowiedzi0008 ) 2 3 A 11. • Za obliczenie molowego stężenia kwasu H
arkusz dII + odpowiedzi0009 1 2 3 4 18. • Za ułożenie równania estryfikacji qh5-
arkusz bII + odpowiedzi0008 ) 2 3 A 11. • Za obliczenie molowego stężenia kwasu H
arkusz eII + odpowiedzi0007 1 2 3 4 li. • Za ustalenie liczby moli cząstec z.ek r
arkusz bII + odpowiedzi0002 Zadanie 5. (4 pkt.) Przeprowadzono doświadczenie przedstawione za pomocą
arkusz dI + odpowiedzi0009 1 2 .? 4 12. • Za prawidłowo ułożone równanie 2 NO + O, — 2 NO? 1 1 13.
arkusz bI + odpowiedzi0009 I 2 3 4 10. • Za u* zer e kazdc-go poprawnego równania po 1 pki np. Ba(O
arkusz bI + odpowiedzi0009 I 2 3 4 10. • Za u* zer e kazdc-go poprawnego równania po 1 pki np. Ba(O
więcej podobnych podstron