arkusz dII + odpowiedzi0007

^2
10.
Za napisanie równania kinetycznego przy zwiększonym x-krotnie ciśnieniu v, = k-x*-cf,0-x*Co,
Za obliczenie, ile razy zwiększono ciśnienie
k-x'-c:*<rx-c0>
^ ‘ CNO ' C0,
= 125; x = 5
Za podanie wyrażenia na stałą równowagi reakcji
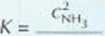
( H2 ' CH,
• Za obliczenie stałej równowagi K - 2
• Za obliczenie początkowego stężenia każdego substratu }>o 1 pkt
|
N, + 3H, 5= |
2NH, | |
|
stan początk. |
x y |
0 |
|
zmiany stęż. |
-2 -6 |
+4 |
|
stan równow. |
x — 2 y-G |
4 |
|
x - 3 mol • dm |
* y = 8 mol • dm ‘ |
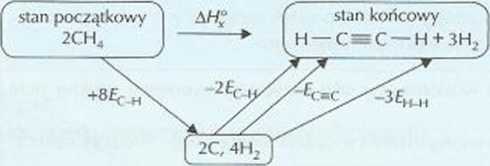
II. • Za przedstawienie schematu
znak to energia dodana, niezbędna do rozerwania wiązań; znak to energia wydzielona przy tworzeniu wiązania
1
2x1
4
2
12.
13.
*
14. •
Za obliczenie zmiany entalpii
ii - 2f( _H - =r - 3£h_h A//., = 382 k| (reakcja jest endoenergetyczna)
Za prawidłowo ułożone równania połówkowe po 1 pkt utlenianie: UCHO + 30H —► HCOO + 2e + 2H,0 redukcja: I, + 2e —► 21 Za dobór współczynników
I łCł łO + l2 + 3NaOH —* HCOONa + 2Nal + H,0
Za ułożenie każdego równania po 1 pkt
I H2SOj + 2CH,COONa — Na,SO, + 2CH3COOH
II 2CH,COOH + Na,CO, —* 2CHłCOONa + H,0 + CO,?
III M ,S04 + Na,SO, —- Na,SO., + 11,0 + SO?T Za uszeregowanie' kwasów
CO, ■ H,0 lub H,CO„ CH,COOH, H,SOJ# H,S04
Za wyjaśnienie
kwas siarkowy{VI) jest mocniejszy, gdyż stopień utlenienia siarki w tym kwasie jest wyższy, a promień atomu centralnego — mniejszy
1 3
2x1
1 3
3x1
1
2
4
2
82
Wyszukiwarka
Podobne podstrony:
arkusz dII + odpowiedzi0009 1 2 3 4 18. • Za ułożenie równania estryfikacji qh5-
arkusz bI + odpowiedzi0009 I 2 3 4 10. • Za u* zer e kazdc-go poprawnego równania po 1 pki np. Ba(O
arkusz bI + odpowiedzi0009 I 2 3 4 10. • Za u* zer e kazdc-go poprawnego równania po 1 pki np. Ba(O
arkusz dII + odpowiedzi0008 _2_ 15. • Za obliczenie stężenia jonów wodorowych w roztworze (x) C0H
arkusz cII + odpowiedzi0007 2 10. Za prawidłowe określenie zmiany pH w każdym z roztworów po I pkt a
arkusz bII + odpowiedzi0007 cc Za interpretację równania CO<B) + HaOw stężenia reagentów (mol-d
arkusz bII + odpowiedzi0009 1 2 3 4 17. Za podanie równań czterech reakc ji po i pkt (przyjmuje się
arkusz dII + odpowiedzi0003 Zadanie 10. (4 pkt.) W stanic równowagi reakcji N2<s> + 3H2Ik, ► 2
arkusz dI + odpowiedzi0009 1 2 .? 4 12. • Za prawidłowo ułożone równanie 2 NO + O, — 2 NO? 1 1 13.
arkusz dII + odpowiedzi0004 Zadanie 13. (4 pkt.) Ułóż równania reakcji wykonanych w doświadczeniu i
więcej podobnych podstron