BK2

3.3. STRUKTURA I WŁAŚCIWOŚCI WODY
Cząsteczka wody składa się z atomu tlenu związanego kowalencyjnie z dwoma atomami wodoru. Dwa wiązania O— H tworzą kąt 105° (Rys- 3-1)- W obrębie cząsteczki wody dochodzi do częściowej segregacji ładunków: atomy wodoru wykazują ładunek dodatni natomiast atom tlenu — ładunek ujemny. Ładunki te równoważą się wzajemnie, w wy-njjcu czego cząsteczka wody nie wykazuje żadnego ładunku netto. Segregacja ładunków na cząsteczce wody oraz jej kształt powodują, iż jest ona cząsteczką spolaryzowaną (dipolem). Cząsteczki wody przyciągają się wzajemnie, a występujące między nimi oddziaływania elektrostatyczne noszą nazwę wiązań wodorowych. Wiązania te sprawiają, że 80% wolnej wody w komórce (nie związanej z powierzchnią makiomolekuł) tworzy
riwie pary niesparowanych elektronów nadają ładunek ujemny (netto)
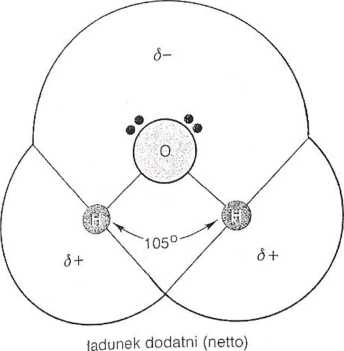
pys. 3.1. Schemat struktury cząsteczki wody. Dwa wiązania kowalencyjne między atomami wodoru i atomem tlenu tworzą kąt 105°. Asymetria rozmieszczenia ładunków elektrycznych na cząsteczce wody umożliwia powstawanie wiązań wodorowych z innymi cząsteczkami wody
pseudokrystaliczną sieć, zbudowaną z szybko powstających i zanikających agregatów, tzw. gron (ang. clusters), (rys. 3.2). Czas życia takiego grona wynosi zaledwie około 10"11 sekundy. Wielkość gron zależy od temperatury: wzrost temperatury powoduje ich zmniejszenie.
Polarne właściwości cząsteczki wody sprawiają, że:
• .Test ona doskonałym rozpuszczalnikiem, szczególnie dla substancji obdarzonych ładunkiem elektrycznym, gdyż cząsteczki wody wiążą się siłami elektrostatycznymi z powierzchnią jonów, tworząc otoczki wodne (rys. 3.3) lub z polarnymi grupami białek i polisacharydów, tworząc powłoki hyd-ratacyjne.
• Ma duże ciepło właściwe (trzeba dostarczyć dużą ilość energii cieplnej, aby podnieść jej temperaturę o 1°C) oraz duże ciepło parowania (zmiana stanu skupienia wody, a więc przejście z fazy płynnej w fazę gazową, wymaga dostarczenia dużej ilości energii cieplnej). Właściwości te umożliwiają roślinie utrzymanie temperatury ciała na stosunkowo stałym poziomie mimo znacznych nieraz zmian temperatury środowiska zewnętrznego (patrz rozdz. 8.4.1).
• Są podstawą takich zjawisk, jak kohezja (wzajemne przyciąganie się cząsteczek wody), która zapewnia dużą wytrzymałość słupa wody na rozciąganie, adhezja (przyciąganie wody przez naładowane elektrycznie powierzchnie, np. ściany komórkowe), a także napięcie powierzchniowe (przyciąganie się cząsteczek na styku fazy wodnej i gazowej jest większe w obrębie fazy wodnej niż w obrębie fazy gazowej). Zjawiska te odpowiadają za przemieszczanie się wody w rurkach kapilarnych i w ścianach komórkowych, w których występują liczne mikroskopowe

'H.
.H'
-O'
O'
\
H
H —O
'0
H
O—H
H
’0-
0 —H
. H
H
H —0
' H —Ó.....XH H
H HX XH V H ° \ °‘ K /H
H
‘0
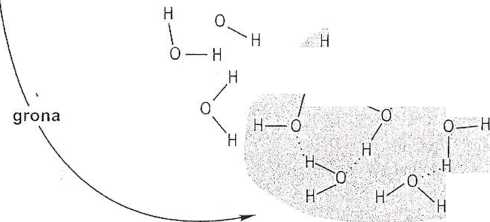
Rys. 3.2. Międzycząsteczkowe oddziaływania wody. Wiązania wodorowe między cząsteczkami umożliwiają tworzenie się agregatów o uporządkowanej strukturze pseudokrystalicznej. Takie agregaty trwają krótko, gdyż w wyniku termicznego pobudzenia ulegają rozbiciu, co prowadzi do powstania bardziej-przypadkowych konfiguracji (Wg: McKersie i Leshem 1994. Stress and Stress Coping in Cultivated Planłs. Kluwer Academic Publishers, s. 148, zmodyfikowany).
+oY_o+
+<? Q
+ +
Rys. 3.3. Otoczki hydratacyjne jonu ujemnego i dodatniego (Strebeyko 1956. Woda i światło w życiu rośliny. PWN, s. 9).
szczeliny. Zjawisko kapilarności powoduje, że powierzchnie ścian komórkowych bezpośrednio wystawione na działanie powietrza (np. ściany komórek mezofilu liścia) pozostają wilgotne i nie zasychają. Jednakże nie jest ono powodem przemieszczania się wody w funkcjonujących naczyniach ksylemu, gdzie woda tworzy ciągłą kolumnę od korzenia do liścia i nie powstają powierzchnie styku powietrze-woda. Przyczyny ruchu wody w ksylemie omówiono w rozdz. 3.8.4.
Wyszukiwarka
Podobne podstrony:
CCF20091008�026 i ujemny, co nadaje jej właściwości wody łączą się ze sobą przez wii iwadropolu). Po
Moduł 1. Informacje wprowadzające3. Struktura egzaminu zawodowego Egzamin zawodowy składa się z częś
IMGC67 [slajdy] Średni ciężar cząsteczkowy Polimery składają się z wielu makrocząsteczek N, o ciężar
page0209 205 cząsteczka wodoru składa się z 2 atomów (molócules ćlemen-taires), a tlen z wodorem łąc
Moduł 1. Informacje wprowadzające3. Struktura egzaminu zawodowego Egzamin zawodowy składa się z częś
Slajd11 Sekwencje insercyjne IS- ki. IRyc. 2. Struktura prostego elementu ruchomego IS10 składająceg
71 (227) 73Zadanie 138. S Cząsteczka fosfolipidu składa się z dwóch części: „główki” i „ogonka” (rys
46 VTLS W BIBLIOTEKACH POLSKICH STRUKTURA REKORDU Rekord w formacie wymiennym składa się z nagłówka
Moduł 1. Informacje wprowadzające3. Struktura egzaminu zawodowego Egzamin zawodowy składa się z częś
Moduł 1. Informacje wprowadzające3. Struktura egzaminu zawodowego Egzamin zawodowy składa się z częś
1 1811 C) Ol KTnutr**. limfocyt •" .2. Cząsteczka hemu składa, się z: ąjczterech łańcuchów
1 2012 r- d) Krwi • łr.«. e) limfocyt . 2. Cząsteczka hemu skład
1 6635 Cl d) Krwiiin*. e) limfocyt 2. Cząsteczka hemu składa się
EBC - STRUKTURA I FUNKCJE • Rada Prezesów (Zarządzająca): o składa się z członków Zarządu i prezesów
Clipboard69 Budowa DNA Cząsteczka DNA składa się z dwóch połączonych ze sobą długich
więcej podobnych podstron