Fiz2

ima ; do zadań rachunkowych:
:nie normalne: p()=101325Pa~ 105Pa, eratura normalna: T0= 273K.
ość 1 mola gazu przy ciśnieniu normalnym: V0= 2,24 • 10_2m3,
łAvogadra: NA= 6• lO23-^-,
związaniach potraktuj gazy jak gaz doskonały.
Powietrze zajmuje objętość 2 dm3 w temperaturze 15°C i pod ciśnieniem 105 Pa. Pod jakim ciśnieniem powietrze to zajmie objętość 4 dm3 w temperaturze 20°C?
Wyznacz zależność gęstości gazu od ciśnienia i temperatury, korzystając z równania Clapeyrona.
Gaz o masie molowej M ma gęstość p w temperaturze T. Wyznacz ciśnienie tego gazu.
W naczyniu o pojemności V znajduje się N, cząsteczek pierwszego gazu, n2 moli drugiego gazu oraz trzeci gaz o masie m3 i masie cząsteczkowej My Ile wynosi temperatura mieszaniny tych gazów?
Do stalowej butli o pojemności 10 1 wprowadzono 32 g tlenu i 8 g wodoru. Po zadziałaniu iskry elektrycznej w butli powstał gaz o temperaturze 500 K. Oblicz ciśnienie gazu w butli.
W dwóch naczyniach o pojemnościach Vx i V2 są dwa różne gazy o masach m, i m2 oraz masach cząsteczkowych Mx i Mr Naczynia te połączono ze sobą i gazy się wymieszały, zachowując tę samą temperaturę. Ile wynosi ciśnienie tej mieszaniny gazów?
W butli stalowej znajduje się tlen pod ciśnieniem 250 atm (atmosfer) w temperaturze 27°C. Ile wynosi gęstość tlenu, jeżeli w warunkach normalnych ma on gęstość
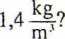
Atmosfera Marsa składa się głównie z dwutlenku węgla. Przy powierzchni planety ciśnienie atmosferyczne jest równe około 0,007 atm. Oblicz gęstość gazu, gdy temperatura przy powierzchni wynosi -73°C. Porównaj z gęstością powietrza na Ziemi
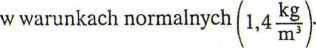
). W pierwszym naczyniu, o pojemności Vx= 3 dm3, znajduje się gaz pod ciśnieniem ;;1=2atm. W drugim naczyniu, o pojemności F2 = 4dm3, jest gaz pod ciśnieniem p2 - 1 atm. Temperatury gazów w obu naczyniach są jednakowe. Jakie będzie ciśnienie Razu, Rdv naczynia połączymy ze sobą? Zakładamy, że przy mieszaniu się gazów
A 1.10. Gaz o objętości początkowej 0,6 m3 sprężono izotermicznie do objętości 0,4m3. Ciśnienie wzrosio przy tym o 2 atm. Ile wynosiło początkowe ciśnienie gazu?
1.11. W jednostronnie zamkniętej rurce szklanej, która leży poziomo, znajduje się słupek rtęci o długości 10 cm. Przestrzeń między rtęcią a zamkniętym końcem rurki wypełnia powietrze na odcinku 30 cm. Jakie będą odległości słupka rtęci od zamkniętego końca rurki po ustawieniu rurki pionowo? Ciśnienie powietrza otaczają-cego rurkę jest normalne.
1.12. Stalowa butla o pojemności 15 dm3 jest otwarta. Ciśnienie atmosferyczne wynosi 1 atm. Do butli tej wtłoczono powietrze w takiej ilości, że w zamkniętej butli ciśnienie wynosiło 100 atm. Jaką objętość zajmowało powietrze przed wtłoczeniem do butli? Zakładamy, że temperatura powietrza się nie zmieniła.
1.13. Ile razy wzrosła objętość gazu podczas jego przemiany izobarycznej, jeśli początkowa temperatura wynosiła Tv a przyrost temperatury jest równy A Z?
1.14. Gaz o masie 12 g zajmuje objętość 4 dm3 w temperaturze 177°C. W jakiej temperaturze gęstość gazu wyniesie 6 • 10~3 ^7> jeśli ciśnienie pozostanie jednakowe?
1.15. Gaz ma w stanie początkowym objętość 10 dm3 i ciśnienie 5 atm. Jaką pracę wykonał gaz, jeżeli podczas jego przemiany izobarycznej temperatura bezwzględna zwiększyła się dwukrotnie?
1.16. Gaz oziębiono pod stałym ciśnieniem od 127°C do 27°C. Jak zmieniła się objętość gazu?
f? 1.17. Podczas izobarycznej przemiany gazu pod ciśnieniem 105 Pa objętość jego wzrosła od 5 dm3 do 10 dm3. Do gazu dostarczono też ciepło w ilości 100 J. Oblicz:
a) jaką pracę wykonał gaz,
b) jaka była zmiana jego energii wewnętrznej?
1.18. Ile razy wzrosło ciśnienie gazu podczas przemiany izochorycznej, jeśli początkowa temperatura gazu wynosiła Tj, a przyrost temperatury równy jest ATI
1.19. Powietrze w dętce samochodu ma temperaturę 7°C i ciśnienie 5 atm. He będzie wynosiło ciśnienie tego powietrza podczas jazdy, jeśli temperatura wzrośnie do 12°C? Załóż, że objętość gazu się nie zmieniła.
1.20. W naczyniu znajduje się gaz pod ciśnieniem p, w temperaturze 7j. Gaz ten ogrzano przy stałej objętości do temperatury Tr O ile wzrosło ciśnienie tego gazu?
1.21. Gaz w ilości n moli i o masie molowej M poddano przemianie izobarycznej. Początkowa objętość gazu wynosiła. Vv a temperatura 7j. Podczas przemiany temperatura gazu wzrosła dwukrotnie. Znamy cienło właściwe, pazu r Wwnn^ ™;™»
Wyszukiwarka
Podobne podstrony:
Fiz2 ima do zadań rachunkowych: nienormalne: p0- 101325Pa ~ 105Pa, eratura normalna: T0= 2
27.11.2012Ćwiczenia 5 1 Uzupełnienie do zadań: • 7e - nie zaoszczędziło, ponieważ
;)ane do zadań rachunkowych: pasa cząstki: .V/a = 4.00! 5 u, pasa neutronu: Mą • 1,0037 u,&nb
DSC06562 Grupa A Imię i Nazwisko Sie które stałe fizyczne do zadań rachunkowych: Przyspieszenie
Ważniejsze wzory Tablice pomocnicze do zadań rachunkowych Słowniczek podstawowych pojęć w językach:
KANCELARIA PREZESA RADY MINISTRÓW i£PMRachunkowość zarządcza Do zadań rachunkowości zarządczej
Rozdział 2 przyczyniają się do rozwoju nauki nie mając takich zadań. Współczesny postęp wielu nauk j
Rozdział 18 do specyficznych zastosowań i nie mogą być zaadaptowane do żądań klientów. Tylko kilka j
Tekst do zadań 1.-6. Kakao O ziarnach kakaowych wspominał już Krzysztof Kolumb, ale nie wzbudziły w
Informacja do zadań 14-15. Dwa gazy A i B zmieszane w stosunku molowym nA: wB = 1:4 zajmują w warunk
Tekst do zadań od 1. do 6. Czytamy bardzo mało albo wcale. Może czytanie książek niczego nam nie daj
skach, chętnie będą się podejmowali nowych zadań. A jeśli nie będzie nikogo o odpowiednich kwalifika
Dr Łukaszewicz - Ekonomia20. WPROWADZENIE DO MAKROEKONOMII I RACHUNKU DOCHODU NARODOWEGO Makroekonom
DSC00026 (3) Do zadań komitetu audytu nie należy: • Monitorowanie procesu sprawozd
więcej podobnych podstron