086 3
Uporządkowanie pierwiastków czyli układ okresowy pierwiastków
Ogromna liczba substancji, które naturalnie wystąpują w przyrodzie lub są sztucznie otrzymywane w laboratoriach chemicznych, zbudowana jest 7 niewielu zaledwie pierwiastków. V\ Dodatku podano alfabetyczny spis wszystkich pierwiastków. wraz z symbolami, liczbami atomowymi, masami atomowymi oraz datami odkrycia. Znamy obecnie 105 pierwiastków, które różnią się między sobą własnościami oraz rodzajem tworzonych związków chemicznych. Własności te nie są przypadkowe, lecz w zadziwiający sposób zależą od budowy atomów pierwiastka i jego masy atomowej.
Czy można logicznie uporządkować wszystkie pierwiastki? To pytanie zawsze frapowało chemików. Rosjanin Dymitr l. Mendclejew (1834-1907) i Niemiec Lothar Meyer (1830-1895) opracowali niezależnie od siebie podstawy naturalnego systemu klasyfikacji, który nazwano układem okresowym pierwiastków (1869). Uporządkowali 60 znanych wówczas pierwiastków według wzrastających mas atomowych, rozpoczynając nowy szereg za każdym razem, gdy kolejny pierwiastek był podobny do pierwszego z poprzedniego szeregu. Musieli przy tym pozostawiać luki na pierwiastki, których jeszcze nie znali, a których własności Mendelejew przepowiada! z zadziwiającą dokładnością.
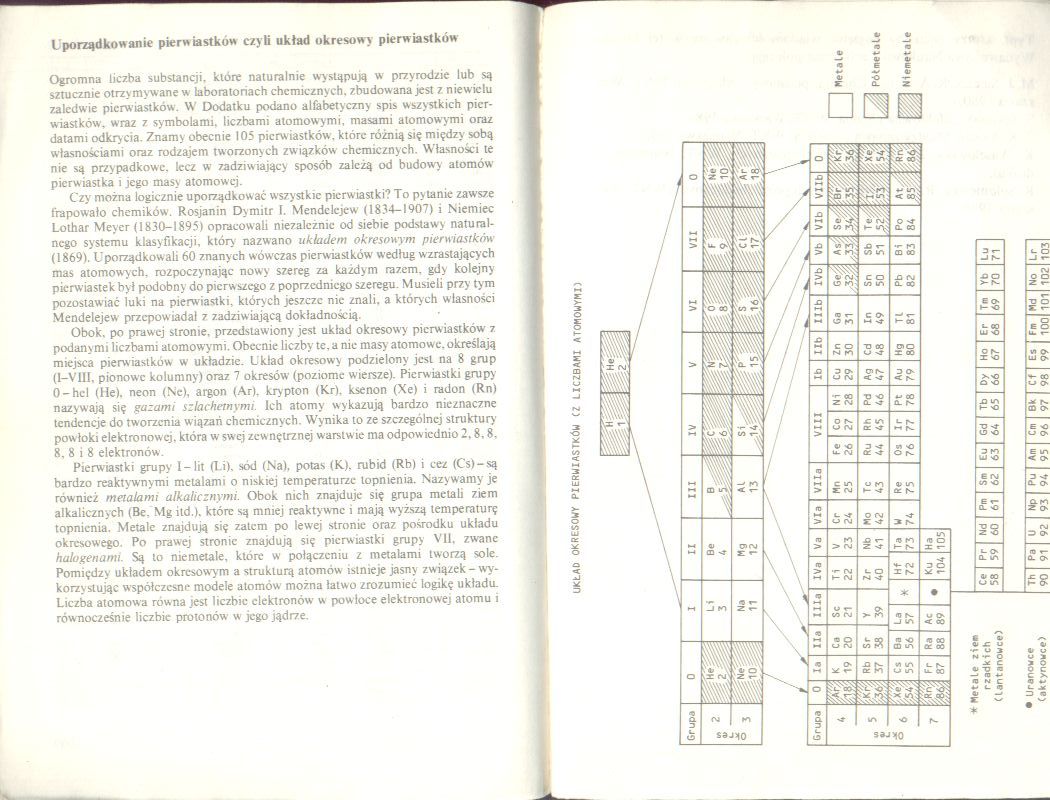
Obok. po prawej stronie, przedstawiony jest układ okresowy pierwiastków z podany mi liczbami atomowymi. Obecnie liczby tc. a nie masy atomowe, określają miejsca pierwiastków w układzie. U kład okresowy podzielony jest na 8 grup (1—VIII. pionowe kolumny) oraz 7 okresów (poziome wiersze). Pierwiastki grupy 0-hcl (He), neon (Ne), argon (Ar), krypton (Kr), ksenon (Xe) i radon (Rn) nazywają się gazami szlachetnymi. Ich atomy wykazują bardzo nieznaczne tendencje do tworzenia wiązań chemicznych. Wynika to ze szczególnej struktury powłoki elektronowej, która w swej zewnętrznej warstwie ma odpow iednio 2.8,8. 8, 8 i 8 elektronów.
Pierwiastki grupy I-lit (l.i). sód (Na), potas (K), rubid (Rb) i cez (C's)-są bardzo reaktywnymi metalami o niskiej temperaturze topnienia. Nazywamy je również metalami alkalicznymi. Obok nich znajduje się grupa metali ziem alkalicznych (Be. Mg itd.). które są mniej reaktywne i mają wyższą temperaturę topnienia. Metale znajdują się zatem po lewej stronic oraz pośrodku układu okresowego. Po prawej stronic znajdują się pierwiastki grupy VII. zwiane halogenami. Są to niemetale, które w połączeniu z metalami tworzą sole. Pomiędzy układem okresowym a strukturą atomów istnieje jasny związek - wykorzystując współczesne modele atomów można łatwo zrozumieć logikę układu. Liczba atomowa równa jest liczbie elektronów w powłoce elektronowej atomu i równocześnie liczbie protonów w jego jądrze.
□
UKŁAD OKRESOWY PIERWIASTKÓW (Z LICZBAMI ATOMOWYMI)

Wyszukiwarka
Podobne podstrony:
Image2 18C 8 Układ okresowy pierwiastków 2 He Widok Podstawowe informacje Rozpowszechnienie Kalkulat
Image3 18C 8 Układ okresowy pierwiastków 2 He Widok Podstawowe informacje Rozpowszechnienie Kalkulat
Image4 C 5 Układ okresowy pierwiastków 18 2 He Widok Podstawowe informacje Rozpowszechnienie Kalkula
I i I UKŁAD OKRESOWY PIERWIASTKÓW — , aWA łaVISB/ « ™ m<A ’ J‘s W®.5 S4 ji? 3.5- .•
UKŁAD OKRESOWY PIERWIASTKÓW CHEMICZNYCH f>7 -25 • Symbol ■ piorwlaatka
UKŁAD OKRESOWY PIERWIASTKÓW E 8 nip głównych [e7] l 0Gmi U ■!II ■ » »• r
imię i nazwisko kl.vta ocena WERSJA ASprawdzian: Budowa atomu a układ okresowy pierwiastków
UKŁAD OKRESOWY PIERWIASTKÓW »»«•» Motl ir--- ^ Mm i* lAR # 1 n»»-«
UKŁAD OKRESOWY PIERWIASTKÓW meridian® IOPAC (tWOl n«»l » Itr,ku poitkm nar>4 «ntv*u
Lekcja 4I Układ okresowy pierwiastków Współczesny układ okresowy został zbudowany w oparciu o strukt
Ukl okres (2) kolor 1 IA 18 O • 1 2,1 I-I 1312 n UKŁAD OKRESOWY PIERWIASTKÓW 2372
uklad Układ okresowy pierwiastków Hł2ioo Herbata po
uklad okresowy 18Układ okresowy pierwiastkówHe2 ,H 1,00794 2 liczba atomowa (por
UKŁAD OKRESOWY PIERWIASTKÓW CHEMICZNYCH rJ_ 1.0 H 1 1 Wodór 2 UKŁAD OKRESOWY masa atomowa m symbol c
UKŁAD OKRESOWY PIERWIASTKÓW 1 Uktad
układ okresowy 3 UKŁAD OKRESOWY PIERWIASTKÓW CHEMICZNYCH Masa atomowa MANGAN- Nazwa
więcej podobnych podstron