CCF20110121�042

Twoja matura - Chemia <]] Beata Ostrowska
VI.
Równowaga chemiczna
Poziom rozszerzony
Określać, jak zmieni się położenie stanu równowagi chemicznej po zmianie temperatury
i ciśnienia.
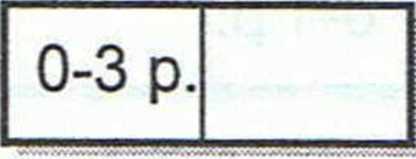
1. Jak podwyższenie temperatury i obniżenie ciśnienia wpłynie na położenie stanu równowagi podanych reakcji?
a) CO(g) + 3H2(g) CH4(g) + H20(g) AH = —205,9 kJ
b) N02(g) +*NO(g) +l/202(g) = +57,1 kJ
c) N2(g) + 3H2(g) 2NH3(g) = -92,4 kJ
0-6 p.
|
Reakcja chemiczna |
Wzrost temperatury |
Obniżenie ciśnienia |
|
a | ||
|
b | ||
|
c |
Proponować sposoby zmiany położenia stanu
równowagi.
Zapisywać wyrażenie na ciśnieniową stałą równowagi dowolnej reakcji odwracalnej na podstawie równania stechiometrycznego.
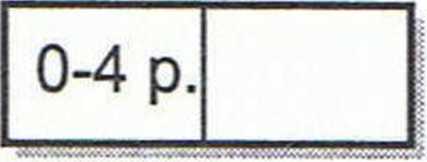
2. Podaj trzy sposoby przesunięcia stanu równowagi reakcji w prawo.
CO(g) + 2H2(g) sf* CH3OH(aq.) A//= -90,47 kJ
I sposób_
II sposób_
III sposób_
3. Podaj wzory określające stałą równowagi Kp podanych reakcji.
a) C2H6(g) C2H4(g) + H2(g)
b) 4HCl(g) + 02(g) 2H20(g) + 2Cł2(g)
c) 2PbO(s) + C(s) 2Pb(s) + C02(g)
d) 2ZnS(S) + 02(g) 2H20(g) + 2S02(g)
|
Reakcja |
Wyrażenie na ciśnieniową stałą równowagi |
|
a | |
|
b |
• |
|
c | |
|
d |
VI. Równowaga chemiczna - Poziom rozszerzony
—A
Wyszukiwarka
Podobne podstrony:
CCF20110121�058 Twoja matura - Chemia <J Beata OstrowskaObliczenia z wykorzystaniem pojęcia molPo
CCF20110121�018 Twoja matura - Chemia <J Beata Ostrowska <01 substancjach chemicznych. 0-3 p.
CCF20110121�026 Twoja matura - Chemia <]] Beata Ostrowska Układać równanie reakcji chemicznej na&
CCF20110121�034 Twoja matura - Chemia <]] Beata Ostrowska <]]V.Szybkość reakcji chemicznej. Re
CCF20110121�038 Twoja matura - Chemia <3 Beata Ostrowska <3Szybkość reakcji chemicznej. Reakcj
CCF20110121�044 Twoja matura - Chemia <]] Beata Ostrowska Obliczać stężenia równowagowe na p
CCF20110121�104 Twoja matura - Chemia <]] Beata Ostrowska <]]Ustalanie wzorów związków chemicz
CCF20110121�108 Twoja matura - Chemia <J] Beata Ostrowska <]] Ustalać wzór związku chemicznego
CCF20110121�102 Twoja matura - Chemia <J Beata Ostrowska <]] XIV. Ustalanie wzorów związków ch
CCF20110121�002 Twoja matura - Chemia Beata Ostrowska <]] XI. Tlenki, kwasy, za
CCF20110121�004 Twoja matura - Chemia Beata Ostrowska <J] Zapisywać symbol nukl
CCF20110121�155 Twoja matura - chemia <H Beata Ostrowska<CH6. H azot 7. © . . © Na- -Fi -N
CCF20110121�171 Twoja matura - chemia <B Beata Ostrowska<U 3. Wielkość stopn
CCF20110121�050 Twoja matura - Chemia <]] Beata Ostrowska <3 Odczytywać i interpretować i
CCF20110121�066 Twoja matura - Chemia <3] Beata Ostrowska <3]X.Dysocjacja jonowa. Reakcje w ro
CCF20110121�006 Twoja matura - Chemia <2 Beata Ostrowska <3jBudowa atomu i promieniotwórczośćP
CCF20110121�010 Twoja matura - Chemia <]] Beata Ostrowska <u 20 .Wskaż zapisy klatkowe elektro
więcej podobnych podstron