CCF20130210�005

Zadanie 10.
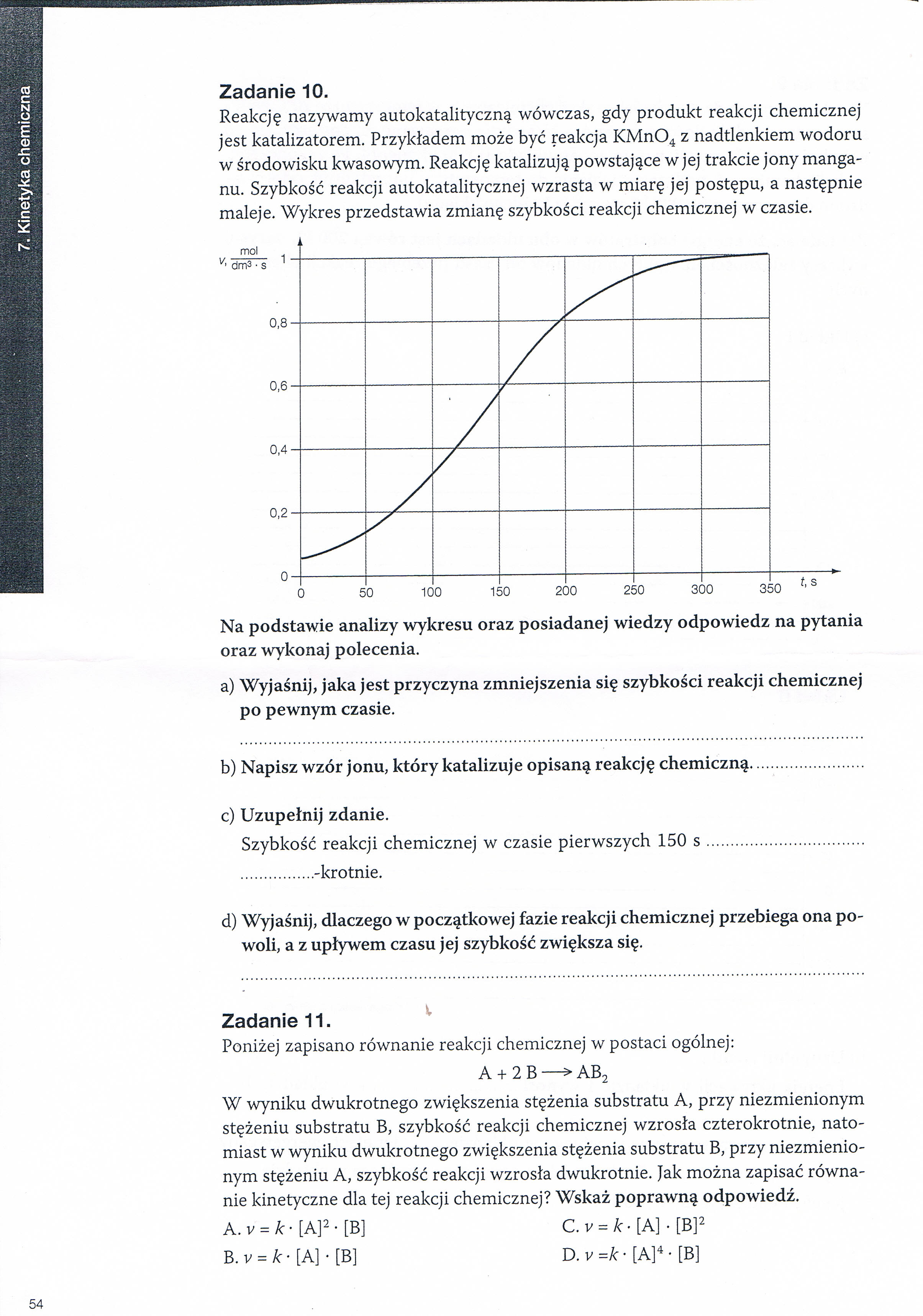
Reakcję nazywamy autokatalityczną wówczas, gdy produkt reakcji chemicznej jest katalizatorem. Przykładem może być reakcja I<Mn04 z nadtlenkiem wodoru w środowisku kwasowym. Reakcję katalizują powstające w jej trakcie jony manganu. Szybkość reakcji autokatalitycznej wzrasta w miarę jej postępu, a następnie maleje. Wykres przedstawia zmianę szybkości reakcji chemicznej w czasie.
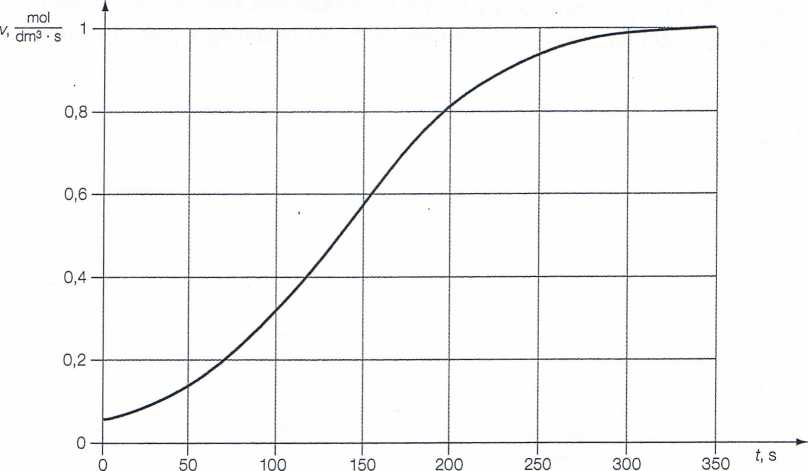
Na podstawie analizy wykresu oraz posiadanej wiedzy odpowiedz na pytania oraz wykonaj polecenia.
a) Wyjaśnij, jaka jest przyczyna zmniejszenia się szybkości reakcji chemicznej po pewnym czasie.
b) Napisz wzór jonu, który katalizuje opisaną reakcję chemiczną........................
c) Uzupełnij zdanie.
Szybkość reakcji chemicznej w czasie pierwszych 150 s.................................
................-krotnie.
d) Wyjaśnij, dlaczego w początkowej fazie reakcji chemicznej przebiega ona powoli, a z upływem czasu jej szybkość zwiększa się.
Zadanie 11.
Poniżej zapisano równanie reakcji chemicznej w postaci ogólnej:
A + 2 B —> AB2
W wyniku dwukrotnego zwiększenia stężenia substratu A, przy niezmienionym stężeniu substratu B, szybkość reakcji chemicznej wzrosła czterokrotnie, natomiast w wyniku dwukrotnego zwiększenia stężenia substratu B, przy niezmienionym stężeniu A, szybkość reakcji wzrosła dwukrotnie. Jak można zapisać równanie kinetyczne dla tej reakcji chemicznej? Wskaż poprawną odpowiedź.
K.v = k- [A]2 • [B] C. v = k ■ [A] • [B]2
B. v = A- - [A] • [B] D. v=k- [A]4- [B]
54
Wyszukiwarka
Podobne podstrony:
CCF20120309�001 Zadanie 10. (1 pkt) Funkcja liniowa /(-y) = (-4 - m)x + 4 jest rosnąca dla m należąc
CCF20120309�001 (2) Zadanie 10. (1 pkt) Wykres funkcji liniowej znajduje się w II i IV ćwiartce ukła
logarytmy zadania5 5.10. Korzystając /. definicji logarytmu, obUcz v, gdy. 5.10.1. &nbs
85139 strona4 (5) Zadanie 10. Jak nazywa się przedstawiona na rysunku technologia montowania podzesp
Kant a filozofia idealizmu niemieckiego 67 tylko wówczas, gdy jednocześnie świadomość nie jest
Spalanie dyfuzyjno - kinetyczne zachodzi wówczas, gdy do spalenia niezbędne jest zarówno powietrze p
P5101292 Poztom podstawowy: Zadania 1 <2 punkty) tttiMl tr mnM* klasyfikacji reakcji chemicznych
/ Zadanie 10 Zrealizować układ sterowania klimatyzatora. Cykl pracy układu przedstawiony jest na rys
również niską ceną, co jest możliwe do osiągnięcia jedynie wówczas, gdy produkcja soli litowej nie j
Dygresja Technika ta działa tylko wówczas, gdy porównujemy zmienne z literałami. Jest to mniej intui
CCF20130404�003 ^Zadanie 886. %
CCF20120118�005 17. Wydajność reakcji chemicznej: 2 N02 = N204 AH° = -61 kJ/mol wz
więcej podobnych podstron