DSC03468
VłłU*nMSyMil Warszaws*!
YłtfUttt Choma
Warszawa. 28 maja 2001
Egzamin z Chomil
dla studentów I roku Wydziału Geologii
ZESTAW 1
Imię I nazwisko:
Taoria
0(14 P.) Giinheoc rv»nki (a) Pooaj sym&ot. konńgurację elektronowa I stopnie uUenienla glinu. (t» Metaliczny okn rozpuszcza się w (wyb erz Jedną lub więcej ^żlrwoW. p^a^c krOiWe uzasadnienie). rozcieńczonych kwasach. roztworach mocnych zasad, stężonym HNOj. (C) WSrod wymienionych substancji / minerałów wskaż te. w których Al;Oj jest głównym składnikiem: ktlcyl. kwarc /Im, korund (d) Wskaż zwózki kióre tą Imdno rozpuszczalne w wodzie AtPO,. AlrfSO&rtKNOib. AI(OH),
/ (8 p) Naszkicuj kszian cząsteczki CjH«. Zaznacz I scharakteryzuj występujące tam typy wiązań.
' OkrcSJ typ hybrydyzacji atomu węgla w tej cząsteczce
/ (7 p.) Omów i wyjainy zmiany energ.J jonfcaqi pierwiastków w układzie okresowym.
{2$ (5 p.) Dte pewnej reakcji chemkanej AH i AS są ujemne Czy reakcja ta może przebiegać ^"^samorzuinieTKrdlkouzaaaflni; — ~~
0(15 p.) Zapisz icnpwo zbilansowane równania reakcji chemicznych:
• tlenku mognezu z kwasem sierkowym(Vlj,
• węglanu wapnia z kwasem solnym.
• siorczonu(VI) sodu z chlorkiem bani.
• mnnganianu{Vil) potasu z chłoikium soilu w liooowlsku kwnsnym.
• fłuonj z wodą
Zadaniu
1. (15 p.) Obleź pH roztworu NaOH o sięzeniu 1.5 % wag (gęaro« « 1 farS). Masy motowe: H - 1; O - 16; Ni • 23 ę/n>oł
2. (20 pj Oblicz pH rozgrom chlorku amonu o stężeniu 0.25 moWm* i objętotd 0.5 Om3. Jak zmieni się pH lego roztworu po utworzeniu buforu przez dodanie 0,2 mołe NH, ? pK« dła jonu NH/ » 9 2
3 (15 p.) OMcz rozpuszczalno^ molową (mot/dm3) PbF,. * 2 5 10-*

V
* «
' o
‘V l
<
' < /
• **./
\
;
lvł * *■ ° * • • * -* V*
".H!4 "
o ) *• s-s/ /.
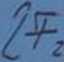
Uniwersytet Warszawski Wydział Chemii

ZESTAW 4
Egzamin z Chemii dla studentów i roku Wydziału Geologi

*lj (14 p.) sim/ka I id związki, (a) Podaj symbol, konfigurację elektronową I stopnie utlenienia siarki, (p) wśród wymiamonych substancji / minerałów wskaż te. w których siarczan(VI) stanowi główny składnik: kelcyl. baryt, piryt, anhydryt, (c) Wskaż siorczany(Vł). które są trudno rozpuszczalna w wodzie: AI,(SO«)j. BbS04. PbS04, K.-S04. (d) Wyjaini), dlaczego H,SO, Jest mocniejszym kwasem od H,SOj.
X (8 p.) Naszkicuj kształt cząsteczki C*H,. Zaznacz I scharakteryzuj występujące tam typy wiązań. Określ typ hybrydyzacji alomu węgla w lej cząsteczce
Z.) (7 p.) Omów I wyjaśnij zmiany właściwości metalicznych pierwiastków w układzlo okresowym.
(6 p.) Dla pownej reakcji chemicznej óH > 0. a óS < 0. Czy reakcja ta może przebłega^^yjoC*) 'samorzutnie ? Krótko uzasadnij. 1 * -<'? V
(15 p.) Zapisz lonowo zbilansowane równaniJrfcakcjI chemicznych:
- meialicznego cynku z kwasem siarkowym.
• wodorotlenku magnezu z kwasem solnym.
• chlorku srebra z nadmiarem amoniaku,
• krzomlonkl z zasadą sodową.
• manganlanu(VH) poiasu z jodkiem polosu w środowisku kwaśnym.
Zadania
1. (15 p.) Oblicz pH roztworu NaOH o stężeniu 0.8 % wag. (gesto&ć • 1 <ycw3). Masy molowe. H - 1 : O - 35.5; Na - 23 g/mol.
2. (20 p.) Oblicz pH roztworu kwasu octowego o stężeniu 0.22 mot/dm11 objętości 0,5 dmV Jak zmieni się pH tego roztworu po utworzeniu buforu przez dodanie 0.15 mola octanu sodu ? pK, ■ 4.8.
3. (15 p.) Oblicz rozpuszczalność molową (mol/dm5) CaF, K*,» 3.2 10"
. 1
ęoŁ + + k7ot'
C<xrV-^ *=? Qx*ł+2.F~
U
I
Z-W'
—
Wyszukiwarka
Podobne podstrony:
DSC03469 I Warszawski Wydział Chemii Warszawa, 28 maja 2001 Egzamin z Chemii dla studontów I roku Wy
DSC03468 <AmUMki Wftórt Chemii Warszawa, 24 maja 2001 Egzamin z Chemii dla studentów I roku Wydzi
DSC03470 Uniwersytet Warszawski Wydział Chemii Warszawa, 30 maja 2000 E°zamin z Chemii o dla student
DSC03478 Uniwersytet Warszawski Wydział Chemii Warszawa, 30 maja 2000 Egzamin z Chemii _____ _ dla
DSC03473 (2) Wjitnwi, 28 m;a
DSC03469 (2) .t. (S p.) Naszkicuj £ -sOto* ■ Warszawa. 28 maja 2001 teoria Q może przebiegać Unfoit
DSC03469 (2) .t. (S p.) Naszkicuj £ -sOto* ■ Warszawa. 28 maja 2001 teoria Q może przebiegać Unfoit
DSC03466 Uniwersytet Warszawski Wydział Chemii Egzamin z Chemii dla studentów I roku Wydziału Geolog
DSC03475 (2) Uniwersytet Warszawski Wydział Chemii Warszawa, 30 maja2000 Egzamin z Chemii dla studen
DSC03466 ■ Uniwersytet Warszawski Wydział Cłicmii Eezamin z Chemii Warszawa, 30 maja 2000 dla studen
DSC03475 Uniwersytet Warszawski Wydział Chemii Warszawa, 30 maja 2000 Egzamin z Chemii
DSC03476 Uniwersytet Warszawski Wydział ChemiiH H gzamiń-zzGhemii~ Warszawa, 30 maja 2000 dla studen
WARSZAWSKI UNIWERSYTET MEDYCZNY PRZEWODNIK DYDAKTYCZNY DLA STUDENTÓW V ROKU I WYDZIAŁU LEKARSKIEGO R
WARSZAWSKI UNIWERSYTET MEDYCZNYPRZEWODNIK DYDAKTYCZNY DLA STUDENTÓW I ROKU KIERUNKU LEKARSKO
więcej podobnych podstron