img098 2

I hIm-Ih 4.H. < huruklrryslyku *ell SephaioM-
|
Typ |
Zuttarto&ć u^uro/y (%) |
Kn/mUry siumi (pin) |
Zakres ro/d/ialti (iiucł białek kl)a) |
|
Sepharose 2B |
2 |
60 200 |
70 40000 |
|
Sepharose 4B |
4 |
45 165 |
60 20 (XX) |
|
Sepharose 6B |
6 |
45 165 |
10 4000 |
Ponadto istnieje seria żeli Sepharose CL (cross-linked) uzyskanych przez specjał ne usieciowanic ziaren Sepharose za pomocą 2,3-dibromopropanolu, co nadaje im wyjątkową odporność chemiczną z zachowaniem wszystkich cech rozdziału. Pozwala to frakcjonować związki w środowiskach o znacznym stężeniu eluentu, np. w roztworach 6 M mocznika, 4 M chlorku guanidyny itp.
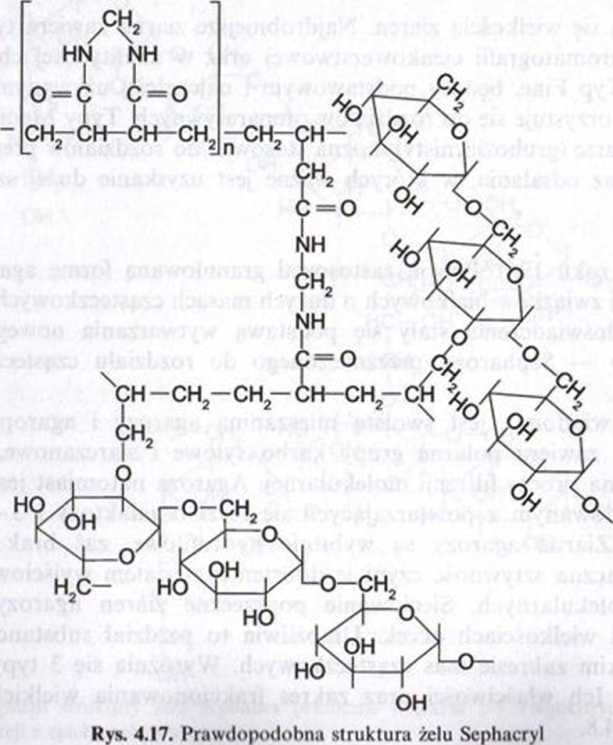
Sephacryl. W ostatnich latach dokonano dalszego udoskonalenia rozdziału cząs teczek w sitach molekularnych. Wytworzono specjalne ziarna o doskonałej zdolnoś ci rozdzielczej, sztywności mechanicznej oraz odporności chemicznej. Uzyskano to przez kopolimeryzację allilodekstranu oraz N,yV'-metyIenoh/sakrylamidu. Stosując specjalną technikę polimeryzacji wyprodukowano sita molekularne o bardzo małych ziarnach typu Supcrfine (S) I nadano tym sitom nazwę Sephacryl. Wycinek prawdopodobnej struktury żelu Sephacryl przedstawia rys. 4.17.
Wszystkie żele Sephacryl cechują się wysoką rozdzielczością oznaczoną fabrycznie 11R (high rcsolution). Charakterystykę kilku typów żeli Sephacryl przedstawia
lab. 4.9.
Tabela 4.9. Zastosowanie żeli Sephacryl
|
Typ |
Zakres rozdziału (in.cz. kDa) |
Zastosowanie | |
|
S-I00 HR |
1- |
100 |
peptydy, białka |
|
S-200 HR |
2- |
250 |
białka osocza |
|
S-300 HR |
10- 1500 |
białka błonowe | |
|
S-400 HR |
20- 8000 |
proteoglikany | |
|
S-500 HR |
40 10000 |
plazmidy, wirusy | |
4.6.2. Teoria filtracji żelowej
Do rozdzielania składników mieszanin o różnych wielkościach cząsteczek, jak już wspomniano, można stosować, struktury porowate (żele), spełniające rolę sita molekularnego. Jony oraz substancje małocząsteczkowe dyfundują łatwo w głąb ziaren żelu, innymi słowy — roztwór zalegający wnętrze żelu jest całkowicie dostępny dla tych substancji. Z drugiej strony wielkie cząsteczki nie wchodzą do wnętrza ziaren żelu, na skutek zatrzymywania ich przez gęstą sieć substancji żelowej. Sacharoza np. zajmuje w stanie równowagi jedynie około 70% roztworu wewnątrz ziaren. Obserwacje te prowadzą do wniosku, że cząsteczki o określonych rozmiarach mogą dyfundować w głąb ziaren żelu tylko na ograniczony obszar. Wnikanie ich do wnętrza ziaren staje się coraz trudniejsze, aż wreszcie ustaje, wskutek coraz gęstszej sieci polimeru. A więc odległość, na jaką dyfunduje określona cząsteczka, ma znaczenie dla czasu ustalenia się równowagi. Przenosząc te rozważania na proces rozdzielczy na kolumnie można stwierdzić, że większe cząsteczki będą eluowane wcześniej niż mniejsze, a zdolność rozdzielcza będzie tym większa, im znaczniejsze okażą się różnice rozmiarów między cząsteczkami rozdzielanych związków.
W technice chromatograficznej przyjęło się wyznaczanie współczynnika podziału K4, który stanowi stosunek stężeń substancji rozpuszczonej w fazie nieruchomej i w fazie ruchomej. Fazą nieruchomą w filtracji żelowej jest rozpuszczalnik zalegający wnętrze ziaren żelu, fazą ruchomą zaś rozpuszczalnik przemieszczający się między ziarnami żelu. W celu wyznaczenia Kó danej substancji należy znać pewne wielkości występujące w procesie filtracji. Słup uformowanego żelu jest wielkością złożoną. Objętość słupa V{ (total volume) wyznacza wzór:
Vt=V0+Vi+Vg (1)
gdzie: V0 — objętość swobodna, czyli objętość rozpuszczalnika zalegającego między ziarnami żelu (objętość zerowa, void volume), V- — objętość wewnętrzna (interna! volumc), tj. ilość rozpuszczalnika wypełniającego wszystkie ziarna żelu, Vg objętość samej substancji żelowej (volume of gel matrix).
141
Wyszukiwarka
Podobne podstrony:
img098 3 I hIm-Ih 4.H. < huruklrryslyku *ell SephaioM- Typ Zuttarto&ć u^uro/y (%) Kn/mUry s
38902 s gliA IH. WODY PODZIEMNE (Ul. 1. Typ wody podziemnej. III.2. Rodzaj zwierciadła wody podziemn
II TtjPIR tfft 7IS Ol3l-Ol3Jl3Tt & fen cniilflfci-M ?ł?Rfagi cpi -ih! him^ §i$ck cifl ^crc< c
54588 Slajd5 (27) Wędrówka maszyn wirtualnych ■ Przykłady iH rvj co . VMotion w VMWare ESX - typ: li
Symbol klasy Typ klasy I rozszerzenie II rozszerzenie IH rozszerzenie Możliwość udziału
skanuj0011 (438) K I___CL- i litr 1 T Tfi i łH ---i. ‘ •O 4i4geb4-M^4uf°l N^f 1 Tri I I I I I T l MM
skanuj0015 (345) 126 Drugi typ dyspozycji zawiera w sobie zarówno elementy ujemnej, jak i dodatniej
skanuj0017 IH układ 4£. /fi. ZOOZ. ^ ko/o*. Karycrcf/ifewJ rr/e-ZcU&opotfroz+i^P/L tfj f YCP/YĆ)
więcej podobnych podstron