kapsu ki�4

11.2.5
Metody kontroli kapsułek
Metody kontroli kapsułek według FP VI obejmują następujące badania.
Badanie jednolitości masy pojedynczych kapsułek. Dotyczy kapsułek o zawartości substancji leczniczej powyżej 2 mg. Masa wypełnienia pojedynczych 20 kapsułek powinna mieścić się dla kapsułek do 300 mg w granicach ± I0% i dla większych 7,5% średniej masy danej serii.
Zawartość w pojedynczej kapsułce oblicza się z różnicy masy 20 kapsułek napełnionych i opróżnionych. Po otwarciu i opróżnieniu kapsułek resztki proszku usuwa się pędzelkiem, a w przypadku cieczy przez przemycie eterem.
Badanie jednolitości zawartości substancji leczniczej. Dotyczy kapsułek o zawartości 2 mg i poniżej oraz o zawartości substancji leczniczej poniżej 2% zawartości kapsułki. Spośród 10 badanych kapsułek zawartość w 9 nie może przekraczać ± 15% zawartości deklarowanej, a w 1 ± 25%.
Badanie zawartości substancji leczniczych. Do oznaczania odważa się próbkę z wymieszanej zawartości co najmniej 10 kapsułek. Zawartość substancji leczniczej należy przeliczyć na średnią masę kapsułki. Dopuszczalne są odchylenia dla kapsułek o deklarowanej zawartości substancji leczniczej do 100 ing± 10%, powyżej 100 mg± 5%.
Określanie czasu rozpadu kapsułek. Kapsułki skrobiowe (według FP V). 5 pustych kapsułek, zanurzonych w 10 ml wody o temp. 20 ± 1°C, powinno utworzyć bczwonnąmasę w czasie nie dłuższym niż 10 min.
Kapsułki żelatynowe (według FP V). 5 pustych, otwieranych kapsułek żelatynowych powinno pęcznieć, mięknąć i rozpuszczać się w wodzie o temp. 36-40°C przy lekkim mieszaniu, w czasie nie dłuższym niż 10 min.
Kapsułki żelatynowe napełnione. Bada się w aparacie do badania czasu rozpadu tabletek (p. str. 204) w wodzie o temp. 37°C, pod obciążeniem krążkami. Czas rozpadu nie powinien być dłuższy niż 30 min; mogą pozostać jedynie nierozpuszczonc fragmenty otoczki.
Kapsułki żelatynowe d o j e 1 i t o w e. Warunki badania i wymagania są analogiczne do tabletek dojclitowych (p. str. 206).
Badania uwalniania substancji leczniczej z kapsułek żelatynowych. Przeprowadza się w sposób podany dla tabletek (p. str. 206).
Określanie czystości mikrobiologicznej. W rozdziale 22 podano wymagania czystości mikrobiologicznej dla leków doustnych, w tym także dla kapsułek. Szczegółową metodykę badań przedstawiono w FP VI.
f 11.3 I
Mikrokapsułki
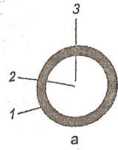
Mikrokapsułki są to kapsułki wielkości 5— 1000 pin, przeciętnie 100-500 pm. Składają się z rdzenia i otoczki. Rdzeń może stanowić substancja stała, ciekła (roztwór, zawiesina, emulsja) lub gazowa. Masa rdzenia wynosi zwykle 30-95% masy mikrokapsułki. W zależności od rodzaju rdzenia mikrokapsułki mają kształt kulisty lub nieregularny, zbliżony do otoczkowanej substancji (ryc. 11.10).
Ryc. 11.10. Kształt mikrokapsułek w zależności od rdzenia: a - kuliste, b, c ~ nieregularne: / - otoczka, 2 - rdzeń 3 - ciecz lub gaz, 4 - kryształ, 5 - kilka kryształów lub granulat.

b

c
PTworzywo otoczki stanowią związki naturalne i syntetyczne. Najczęściej są stosowane: żelatyna, guma arabska, szelak, kalafonia, octanoftalan celulozy, etyloceluloza, karboksymetyloceluloza, metyloceluloza, nitroceluloza, octan celulozy, polialkohol winylowy, poliamidy, glikol polioksyctylenowy, polipropylen, poliwinylopirolidon. Często stosuje się mieszaniny polimerów, np. mieszaninę etylocelulozy i metylocelulozy. W zależności od rodzaju otoczek następuje szybsza lub wolniejsza dyfuzja substancji przez otoczkę. Otoczki mogą być sztywne, elastyczne lub porowate. '
mi
Metody otrzymywania
{ Mikrokapsulki otrzymuje się następującymi metodami:
^Metoda koacerwacji. W metodzie tej wykorzystuje się zjawisko koacerwacji, czyli rozdzielania faz w roztworze koloidów lub polimerów i utworzenia 2 lub więcej faz ciekłych. Koacerwację można przeprowadzić w środowisku wodnym i środowisku bezwodnym.' ’
(„Koacerwacja w środowisku wodnym (wydzielanie fazy hydra-tyzacyjnej). Rdzenie - substancje stale lub ciekłe - zawiesza się lub emulguje w wodnym roztworze materiału otoczkująccgo (np. żelatyny, gumy arabskiej, karmelozy sodowej). Następnie, pod wpływem zmiany temperatury, stężenia, pH, dodatku soli, następuje wydzielanie koloidu substancji wielkocząsteczkowej w postaci ciekłych kropelek, które osadzają się na rdzeniach, łączą się ze sobą i tworzą wokół nich ciekłą ściankę. Ścianki zestala się przez dalszą desołwatację tworzywa. Koacerwacja może mieć również charakter kompleksowy i przebiegać w układzie złożonym z więcej niż jednej substancji koloidalnej, np. gumy arabskiej z żelatyną, żelatyny typu A z żelatyną typu B. Na rycinie 11.11 przedstawiono poszczególne fazy koacerwacji.
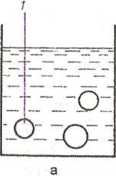
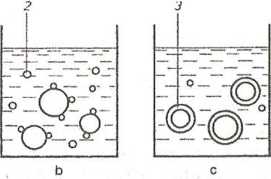
Ryc. 11.11. Mikrokapsułkowanic metodą koacerwacji: a - rdzeń zawieszony w roztworze polimeru (otoczki), b - wydzielanie się koacerwatu, c - ciekły koacerwat otacza rdzeń, d - zestalenie otoczki: 1 - rdzeń, 2 - kropelki koacerwatu, 3 - ciekły koacerwat, 4 - mikrokapsulki.

Wyszukiwarka
Podobne podstrony:
kapsu ki�2 11.2.1Metody otrzymywania Kapsułki żelatynowe można otrzymać metodą zanurzeniową, wytłacz
kapsu ki�3 Ryc. 11.8. Wytwarzanie kapsułek metodą wytłaczania: / - walce, 2 - folia żelatynowa, 3 -
kapsu ki�5 Koacerwacja w środowisku bezwodnym (wydzielanie fazy nie-uwodnionej). Metodą tą można mik
kapsu ki�6 Dyfuzja wody do mikrokapsutki 1_T~—T" Dyfuzja roztworu Rozpus
kapsu ki�7 Ryc. 11.17. Otrzymywanie mikrokapsułek alginianowych: / - roz-twór aiginiatni sodu, 2 - p
kapsu ki�8 Ryc. 11.19. Liposomy - obraz z mikroskopu elektronowego (wg Żawrockicj-Wrzofek). ich wymi
kapsu ki Kwas acetylosalicylowy (0,5 mm) zmieszać z wysuszoną skrobią, zgranulo-wać na sucho, ujedno
skanuj0017 (230) -Z2- 259 Tclbli ca 6.2ZZawlecz ki wg PN- 7S/M- 82001 Dopuszczalne ku tal ty zakończ
więcej podobnych podstron