Lista 1 Cw 2

Ćwiczenia nr 2.
Temat: BUDOWA ATOMU, POWŁOKI ELEKTRONOWE, ORBITALE, WIĄZANIA, WZORY LEWISA ZWIĄZKÓW ORGANICZNYCH.
1. Rozpisz konfigurcje elektronowe dla poniższych pierwiastków i ich jonów.
H, Li, B, C, N, O, F, Ne, Na, Mg, Al, Si, P, S, Cl, Cu, Ge, Br
Li+, HjF, Mg2F przykład:
r. ls 2s zp js jp ja Ne 3s2 3p3 3d°
Ne 3s2 3px' 3py' 3pz'
FF F F F
2. Zaznacz elektrony powłoki walencyjnej w zadaniu nr 1.
przykład: P: ls2 ls2 2p6 3s2 3pJ 3d°
3. rozpisz konfigurację elektronów walencyjnych na orbitalach zhybrydyzowanych (sp, sp2, spJ) w:
C, B, N, O, P, S. Narysuj diagram obrazujący względne poziomy energetyczne dla drugiej powłoki elektronowej.
|
przykład: C: nie zhybrydyzowany: 2s22px! Ppy1 2pz° |
sp: 2p |
X_F- yĄ- z- |
|
sp zhybrydyzowany: 2(sp')2, 2px' 2py 1 |
2sp |
f- -F |
|
sp2 zhybrydyzowany: 2(spi)J, 2px* sp zhybrydyzowany: 2(sp ) |
2s |
_ |
|
Który orbital posiada większą energię: |
3s, 3d, 4s
4s, 3d, 4p
JPx, JPz, jPy
2s, 2sp, 2p
3d, 3sd, 3sp, 3p, 3s
4. Ile wiązań może utworzuć:
C, B, N, P, Al, Mg, H. Wyjaśnij odpowiedź (weź pod uwagę ilość elektronóe I orbitali walencyjnych)
5. Ole orbitali molekularnych powstanie w wyniku superpozycji (nałożenia) dwóch orbitali atomowych? Narysuj kształty orbitali molekularnych powstałych w wyniku nałożenia dwóch orbitali typu:
, dwóch 5, s i p, s i sp, dwóch sp, dwóch /;?
6. Uszereguj poniższe pierwiastki wg rosnącej elektroujemności:
C, Be, F, O, N, B, Li
Na, Si, Mg, S, Cl, P, Al.
At, Br, Cl, F, I
Fr, Rb, J, Cs, Na, Li, K
7. Określ rodzaj wiązania w poniższych związkach:
HC1 (gazowy), NaCl (krystaliczny), H?0, CH_t, N2, CO, CaCL, NH3, NHĆ, BH3, CHCI3, P2O5. (Uwzględnij różnicę elektroujemności pierwiastków tworzących związek oraz stan skupienia).
8. Napisz wzory sumaryczne poniższych związków I określ hybrydyzację atomów C, O, N:
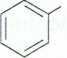
^Br Cl
^OH
Bromobenzen
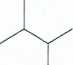
OH
3-mety lo-2-butanol
2-Chłoropropanol H’-
h2 h2
H.C^N^CH.
I
/CH,
Thriethy lamina HsC
Wyszukiwarka
Podobne podstrony:
ćw 1 ĆWICZENIE nr 1 Temat: BADANIE OBWODÓW PRĄDU STAŁEGO ZAWIERAJĄCYCH ELEMENTY LINIOWE I NIELINIOWE
zest ćw laboratoryjnych Zestawienie ćwiczeń laboratoryjnych Nr Temat ćwiczenia Nr Temat ćw iczenia
Grupa 22 Zespół II Ćwiczenie nr 3 Temat ćw.: Wyznaczanie lepkości cieczv Data wykonania
Bez nazwy2 (2) i Ćwiczenie nr Temat SILNIK SPALINOWY DWUSUWOWY Cel ćw:
Bez nazwy 1 (29) I Ćwiczenie nr h Temat: SKRZYNIA PRZEKŁADNIOWA Cel ćw:
Bez nazwy 1 (30) Ćwiczenie nr.Temat: CAŁKOWITE PRZEŁOŻENIE POŁĄCZENIA GWINTOWEGO.
Bez nazwy 1 (31) Ćwiczenie nr Temat: IDENTYFIKACJA KÓL ZĘBATYCH I ŁOŻYSK TOCZNYCH
P5100215 ĆWICZENIE nr TEMAT ĆW ICZENIA: badanie transformatora CEL ĆWICZENIA: zbadanie biegu jałoweg
24497 zest ćw laboratoryjnych Zestawienie ćwiczeń laboratoryjnych Nr Temat ćwiczenia Nr Temat ćw i
skanuj0028 (73) Politechnika Poznańska Instytut Inżynierii Materiałowej GSprawozdanie z ćwiczenia nr
skanuj0023 (86) Komentarze do ćwiczenia nr 8:X[um] W próbce 8.1 jest powłoka Ni-Cu-Ni-Cr, została on
skan050 t~Ą&UFAKADEMIA TECHNICZNO-HUMANISTYCZNAw Bielsku-Białej Ćwiczenie nr 3 Temat: Ciepło
46944 skanuj0048 (27) Politechnika Poznańska Instytut Inżynierii MateriałowejSprawozdanie z ćwiczeni
więcej podobnych podstron