Scan0029 5

2. UKŁAD OKRESOWY PIERWIASTKÓW
Ucząc się chemii w klasach poprzednich zapoznaliście się z krótką tabelą okresową, nazywaną często od nazwiska twórcy, rosyjskiego chemika Dymitra Mendelejewa (1834—1907), układem okresowym pierwiastków Mendelcjcwa. Obecnie przedstawimy inny kształt układu okresowego, nazywany długim układem okresowym:
|
n |
ns |
(n-l)rf |
np |
|
s1 s2 |
d1 d2 d3 d4 ds d6 d1 d« d9 d10 |
P1 p2 p3 p4 p5 p6 ł | |
|
1 |
H |
He | |
|
2 |
Li Be |
B C N O F Ne | |
|
3 |
Na Mg |
(Jdo |
Al Si P S Cl Ar |
|
4 |
K Ca |
Sc Ti V Cr Mn Fe Co Ni Cu Zn |
Ga Ge As Se Br Kr |
|
5 |
Rb Sr |
Y Zr Nb Mo Tc Ru Rh Pd Ag Cd |
In Sn Sb Te J Xe |
|
6 |
Cs Ba |
La Hf Ta W Re Os Ir Pt Au Hg |
Tl Pb Bi Po At Rn |
|
7 |
Fr Ra |
Ac |
|
n |
(n—2)/ | |
|
Pierwiastki przejściowe |
fl f2 f3 p fS f6 fl fS p po fil fi2 f13 f14 | |
|
lantanowce aktynowce |
6 7 |
Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er T Yb Lu Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr |
Ten typ układu okresowego obejmuje pierwiastki (lantanowce i aktynowce) wypełniające orbitale /, które zostały umieszczone poza tabelą.
Na podstawie długiego układu okresowego wyprowadzić możemy np. następujące wnioski:
A. W kierunku poziomym tabela podzielona została na siedem okresów
54
i
i numer każdego z nich odpowiada głównej liczbie kwantowej orbitalu s, który zaczyna się w nim wypełniać.
B. Liczba pierwiastków w poszczególnych okresach stanowi dwukrot-jiość liczby orbitali, wypełnionych według kolejności energii ns—np, gdzie n oznacza numer okresu, a równocześnie główną liczbę kwantową. Na przykład:
— okres pierwszy zawiera jedynie dwa pierwiastki, ponieważ wypełnia się w nim jedynie jeden orbital, tj. Is;
— okres drugi zawiera osiem pierwiastków, ponieważ w poziomie energetycznym 2s—2p znajdują się orbitale 2s i 2p. W sumie więc wypełniają się cztery orbitale;
— okres czwarty zawiera 18 pierwiastków, ponieważ na poziomie energetycznym 4^—4p poza orbitalami 4.s i 4p znajdują się także oribtale 3d. W sumie więc wypełnia się w tym okresie dziewięć orbitali (jeden s, trzy p i pięć d);
— szósty okres obejmuje 32 pierwiastki, ponieważ wypełnia się w nim 16 orbitali (jeden 5, pięć d, siedem / i trzy p).
W danym okresie układu pierwiastków (rys. 12) wypełniają się orbitale leżące w zakresie poziomów energetycznych ns — np, przy czym n oznacza numer
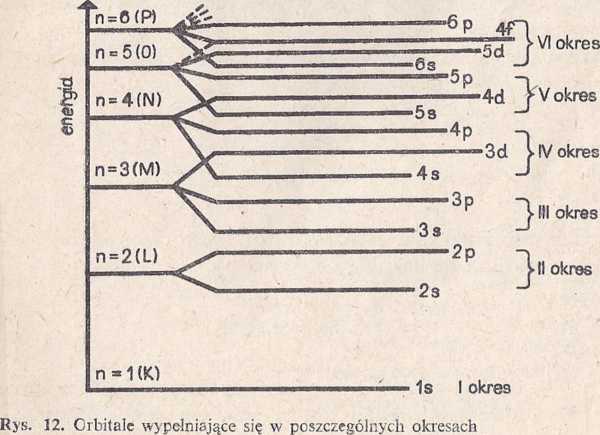
55
Wyszukiwarka
Podobne podstrony:
Image2 18C 8 Układ okresowy pierwiastków 2 He Widok Podstawowe informacje Rozpowszechnienie Kalkulat
Image3 18C 8 Układ okresowy pierwiastków 2 He Widok Podstawowe informacje Rozpowszechnienie Kalkulat
Image4 C 5 Układ okresowy pierwiastków 18 2 He Widok Podstawowe informacje Rozpowszechnienie Kalkula
I i I UKŁAD OKRESOWY PIERWIASTKÓW — , aWA łaVISB/ « ™ m<A ’ J‘s W®.5 S4 ji? 3.5- .•
UKŁAD OKRESOWY PIERWIASTKÓW CHEMICZNYCH f>7 -25 • Symbol ■ piorwlaatka
UKŁAD OKRESOWY PIERWIASTKÓW E 8 nip głównych [e7] l 0Gmi U ■!II ■ » »• r
imię i nazwisko kl.vta ocena WERSJA ASprawdzian: Budowa atomu a układ okresowy pierwiastków
UKŁAD OKRESOWY PIERWIASTKÓW »»«•» Motl ir--- ^ Mm i* lAR # 1 n»»-«
UKŁAD OKRESOWY PIERWIASTKÓW meridian® IOPAC (tWOl n«»l » Itr,ku poitkm nar>4 «ntv*u
Lekcja 4I Układ okresowy pierwiastków Współczesny układ okresowy został zbudowany w oparciu o strukt
Ukl okres (2) kolor 1 IA 18 O • 1 2,1 I-I 1312 n UKŁAD OKRESOWY PIERWIASTKÓW 2372
uklad Układ okresowy pierwiastków Hł2ioo Herbata po
UKŁAD OKRESOWY PIERWIASTKÓW CHEMICZNYCH rJ_ 1.0 H 1 1 Wodór 2 UKŁAD OKRESOWY masa atomowa m symbol c
UKŁAD OKRESOWY PIERWIASTKÓW 1 Uktad
układ okresowy 3 UKŁAD OKRESOWY PIERWIASTKÓW CHEMICZNYCH Masa atomowa MANGAN- Nazwa
układ okresowy 1 IA 1.00794 • 1 2.1 1312 1 H ___________ ( (UKŁAD OKRESOWY PIERWIASTKÓW 18 4.00
więcej podobnych podstron