Zdjŕcie0928

#r —ayl
|
i *r |
A |
» |
c * |
|
1 | |||
|
nr | |||
|
3 | |||
|
4 |
4 -.. J | ||
|
5 |
„ | ||
|
* |
i |
XJ .. | |
|
7 | |||
|
• ^ |
X 1 | ||
|
f I | |||
|
10 | |||
Chemia Pliyogflt l/febortlorium WIMiC, M fok (20111201%) ii
OyiiiwM rlifinlmne I współczynnik iktywniiłcl I k«u
Naiwliho iliiilę ........... (tfwf* ^
I Co lo |mi pólngnlwo?
A) lllnllll Julii lwuizy mola! mc z roztworem swoich Jonów, w którym f44f /**»*,***. t li) tdiłtul Inki iwotzy elektroda zanurzona w roztworze 4&
C) tik Ind jnlil tworzy motał wraz z roztworem anionów, w którym IM ta*** er*ty O) lik Ind |nk| tworzy motał wraz z roztworem swoich kationów, w kl/ffpffr
2. Co lojfisl dgniWO galwaniczne?
A) nkInd noltio/oiiyoli 2 elektrod zanurzonych w ro/lwotm-li, w którym twwt ppmAge samorzutny przcbcy
tonkiiji oliemlozjiid
O) uklnd (Hilnu/oiiyuli 2 elektrod zanurzonych w ro/lwowtli, w którym **mtrf/nh*/ *eakgi lirnac/ag wytwarc pmd jonowy
C) uklnd połączonych 2 elektrod zanurzonych w roztworach, w którym ww^/nriiy ptrWneg seakcji dłeamsmg wytwmt piąd elektryczny -ł*
P) uklnd połączonych 2 elektrod zanurzonych w ro/.lwotaelt, W którym timt/r/nMty ęnśtm% acrikqp rtrairrwj wytwarza pole mignatyauie
3. Prawidłowe zeslawionlo danych dla ogniwa to
A) Anoda % Katoda , AO < 0 -f-
B) Anodo 11 Katoda •, AO < 0
C) Anodn l, Knloda •, AO>0 P) Anoda», Katoda i, AO > o
4, Wartość, klóty ttloAim zmierzyć w elektrochemii Jest
A) poienultil wewnętrzny Ibzy metalicznej ogniwa
B) równina |K>loną)nlów Aiz ogniwa
C) lila eleklnunotoryoznn ogniwa SEM -4-
O) aloionek pracy przonlofienia ładunku z wnętrza roztworu do woltmmAZA*
5. W ogniwie zbudowanym z Zn i Sn zachodzą na anod/Je I k/rtod/t# rerrimyi fiftamn Mamai ^E*^*'/*,*)
A) Sr -»8r' I 2o' I Zn" + 2e* -»Zn0
0) Zn*' ■* 2e -* Zn01 Sn0 Sn2*+2e'
C) Sn" «l> 2o' -* 8n° 1 Zn0 -* Zn2*+2c
D) Zn0 -»Zn" •!* 2e‘ 1 Sn" + 2e* -♦ Sn0 + (
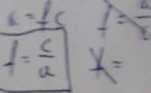
6, Współczynnik aktywności, :f, wyraża stosunek
A) akty wnośol Jonu (a) do stężenia tego jonu w (o) roztwory I jmt wMłk/>4»ia mmmmmm
B) aktywności jonu (tt) do stężenia tego jonu (c) w roztworze i je*t mAMtww.<««ia —
C) Stępnia Jonu (0) do aktywności jonu (a) w roztworze i jest wUiktArJn -
D) ilężettla jonu (0) do aktywności jonu (a) w roztworze I jest wic Ikr * >4 ***«*♦«*/*•>■.«»*
7,Ola rozcieńczenia nieskończenie wielkiego a i f musi spełniać nnMąp>ipv y »«*<***
A) a * o ora#, f -♦ 11 roztwór stąje się roztworem rzeczywistym 0) n —♦ C oraz f 11 roztwór stąje się roztworem rzeczywistym
C) a -* o oraz f ♦- 11 roztwór stąje się roztworem doskonałym
D) a --* o oma f —♦ 11 roztwór stąje się roztworem doskonałym ś
8. Prawo graniczne IJebyo'n-1 lockla opisuje równanie
A) logik* - iz, #lAVI
B) log flk ■ • IK< «UAVI
C) log fU* * • iKylklAI
D) Ak • • |g(g,|AVl
/
A) j « ||iH Joat równa stężeniu molowemu elektrolitu
B) I ■ 1/2i Jasi większa od stężenia molowego elektrolitu
C) I • 1/3 Vot/^* t jest mniąjsza od stężenia molowego olektrołlto O) Ja l/SEOn I Jest równa się stężeniu molowemu elektrofiltr
10. Średni współczynnik aktywności jonów elektrolitu możne wjr/mt./fi mm pnmaer
A) SEM ogniwa zbudowanego z 2 elektrod odwracalnych względem jsmów drtwtto -f
B) SEM ogniwa zbudowanego z 2 elektrod odwracalnych w/gfędem htOł/tw hn4mtpt4idmmt» Q SEM ogniwa zbudowanego z 2 elektrod odwracalnych w/gJfdem mmmn fcnAwegfr tkkmlm D) SEM ogniw# zbudowanogo z 2 elektrod nieodwracalnych w/gJedem JwrAw kadezegft tukaaśm
9. Silę Jonową (I) dla prostych elektrolitów typu 1:1 opisąje równanie
Wyszukiwarka
Podobne podstrony:
Zdjŕcie007 Objętotó
Zdj 25252525EAcie0921 r w w wtw (nr m r w w wtw (nr m ImS Mil alt w Nwym ^RN i mmmm to/ sv hm*** W&a
Zdjŕcie 0015 31 li ,£ uć -V.isiErst */<<•& i * /&/?+<, ZADANIE 2.
Zdjŕcie 0018 tfrJzic: Mk Anionie o 6 WYKONANIE *U>m skladzie
Zdjŕcie 0025 I I Y vv -s, ,vw ° Stopień spęcznienia nasion im zO Ł • WYNIKI Temperatura
Zdjŕcie 0027 ICa cii i wyciągi . Porównać zmiany objętości badanych sub,t.^ vft&{ WNIOSEK
Zdjŕcie 0031 73 73 W. ............. Vil (w«k.rplOf**» I""""" * " &qu
Zdjŕcie0003 ^ ^ OhMMM* OOi m o *ik II O, « .* F*»; 1 . 1 ■ ... *,«v MumntKHl Maty pnalraeiyM w
Zdjŕcie0004 ftHRHii* iKiini hodu *. pt/c/HH , ^IC « (wln^w
Zdjŕcie0007 -,JM Sm »Mmi 1 A la 1 < ; ‘ fe *fcł> »*f.M #i m Ma«fi
Zdjŕcie0008 unittuttSMi tyrtllil •<1><#2f
Zdjŕcie0009 M -
Zdjŕcie0014 I iWMt* >*«*■■ • »»mw (Wb • mnn pftm
Zdjŕcie0018 **•«**. fe a»n f ^mkrym, * Mmm ® **•*> w ptecurywic ’ ’ *ł,,IŁ
Zdjŕcie0019 n !*»*■*■) ■» ft. fn—mwtm mwmamrry w prmśmkr* mci?* Ir
Zdjŕcie0020 CłV*»«W»mi ukodbwynu ® i(l.uyia nynwmu dV» lArowu okn* do odhfMB* wni>M procy od dua
Zdjŕcie004 tematyczny 1. do organizacji I 1.1. Istota nauki zarządzania 1.1.1.
Zdjŕcie006 Literatura: (1 ] (5) 8,1 Istota zmian 8 2 Model procesu zmian .3 R
Zdjŕcie008 • radna i pciwyrsryęlit O* <1 oomog raf icr riych czynników ryryhs pni«MiiM
więcej podobnych podstron