0000013 (17)

Przy określonej różnicy potencjałów między metalem a elektrolitem ustali się stan równowagi, wtedy reakcja 4.39 przebiega w obie strony z jednakową szybkością, proces można uznać za odwracalny. W tych warunkach różnica potencjałów elektrycznych AK = tpMe — <pel zwana potencjałem elektrodowym AK danego metalu wyraża się wzorem Nernsta
AK = AK0-f-— lnc, 4.40
zF
gdzie:
Cj oznacza stężenie jonów metalu w elektrolicie, a z ich wartościowość.
AK0 jest równe różnicy potencjałów przy jednostkowym stężeniu jonów w elektrolicie i nosi nazwę potencjału standardowego danej elektrody. Potencjału tego nie można
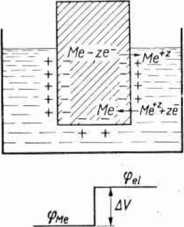
Ryc. 4.7. Potencjał elektrodowy. Skok potencjału A V = ęMc— ast na granicy me-tal-elektrolit w stanie równowagi.

Ryc. 4.8. Ogniwo stężeniowe. Siła elektromotoryczna jest równa różnicy potencjałów elektrodowych: £ = AKt—AK,.
zmierzyć bezpośrednio, wyraża się go różnicą potencjałów ogniwa, w którym drugą elektrodą jest elektroda wodorowa, czyli platyna opłukiwana wodorem przy ciśnieniu i utm, zanurzona w roztworze o jednostkowym stężeniu jonów wodorowych.
Wzór Nernsta 4.40 otrzymuje się zakładając, że w stanie równowagi potencjały elektrochemiczne atomów metalu (pMe) oraz jego jonów (aj) w elektrolicie są sobie równe, wtedy
PoMc+Win cMe + <pMczF = y.oj+RT\n cj+<pelzF
stąd
Po/ Po Me
zF

9 Me 9el =
przy czym, jeżeli oznaczyć:
9Me-9cl=AK oraz
1*07 t^oMe zF
= a y„
z uwzględnieniem: ln eMc = 0 (cMe = 1), otrzymuje się wzór Nernsta 4.40.
113
8 — Podstawy biofizyki
Wyszukiwarka
Podobne podstrony:
Slajd30 (34) • Jest to różnica potencjału między środowiskiem zewnętrznym i w
IMG?12 W obszarze ładnej pogody różnica potencjałów między Ziemią a jonosferą osiąga wartość około B
trodą 2, różnica potencjałów między elektrodami zmieniła znak, wychylenie przyrządu w przeciwną
0000010 (17) Zgodnie z 4.27 i 4.29 potencjał chemiczny tego składnika i mieszaniny gazów, względnie
0000067 (4) Dwie molekuły, działając na siebie, są w stanie równowagi przy określonej odległości r0.
Elektrofizjologia > Potencjał spoczynkowy - różnica potencjałów między wnętrzem komórki a jej
IMG?11 Promy kosmiczne w czasie startu chroni się przed piorunami poprzez Średnia różnica potencjałó
62 HENRYK MARKIEWICZ myśli Zachodu. I konkludował, że przy ogromnych różnicach poglądów między
• Napięcie Napięcie UEB - różnica potencjałów między punktami E a B. pizy czym
49394 Slajd30 (34) • Jest to różnica potencjału między środowiskiem zewnętrzn
36805 IMG?03 (2) Miały czas .03:27 Pioruny powodują Odpowiedź. O a zwiększenie różnicy potencjałów m
więcej podobnych podstron