arkusz bI + odpowiedzi0003

Zadanie 11. (1 pkt)
Oblicz stężenie jonów wodorowych w 0,01-molowym roztworze wodnym HŃ02. W temperaturze pomiaru BBf>«en dvsocjac ji HNO w tym roztworze wynosi 13%.
Zadanie 12. (2 pkt.)
f wyniku reakcji tlenku krzemu(IV) z wodnym roztworem NaOH otrzymujemy tzw. szkło wodne. Po ■powadzeniu do szkła wodnego tlenku węgla(IV) strąca się galaretowata bezbarwna substancja. Ułóż ■Mania opisanych reakcji.
Zadanie 13. (1 pkt)
pbe£ cxk/vn roztworów otrzymanych |x> wprowadzeniu do wody następujących substanc ji:
I II III IV
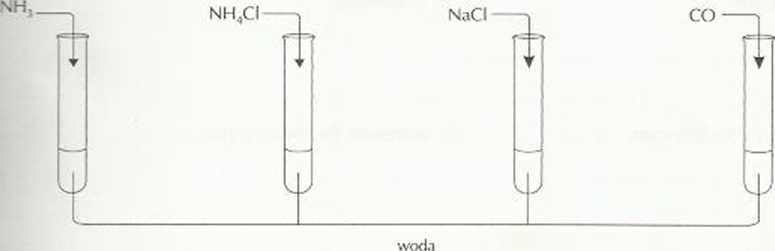
II
IV
Zadanie 14. (2 pkt.)
r czterech zamkniętych probówkach znajdują się bezbarwne gazy: NO, 50 „ O,, Nil,. Określ zawartość każdej probówki na podstawie: a) zachowańi.i gazu fx> otwarciu prolłówki, b) zmiany barwy wskaźnika Miwersalnego.
Zodanie 15. (2 pkt.)
■eakcj,; syntezy amoniaku z wodoru i azotu przebiega z 60-procentową wydajnością. Oblicz, ile mł azotu wzięto do reakcji, jeśli otrzymano 100 nv amoniaku. Objętości gazów mierzono w warunkach normalnych.
Wyszukiwarka
Podobne podstrony:
arkusz bI + odpowiedzi0004 Zadanie 16. (2 pkt.) Siarczek sodu pozostawiony w otwartym naczyniu stopn
arkusz bI + odpowiedzi0005 Zadanie 20. (1 pkt) laboratoryjna metoda otrzymywania tlenku wyglaOI) pol
arkusz bI + odpowiedzi0006 Zadanie 24. (1 pkt) Dym palonego drewna zawiera m.in. mctanal. Wyjaśnij,
arkusz bI + odpowiedzi0007 Zadanie 28. (1 pkt) Dane s<] cztery wzory pierścieniowe i łańc uchowe
img174 18. (5 pkt) Obliczyć stężenie jonów wodorowych i pH roztworu 0,18 molowego kwasu octowego (CH
0000001 (6) Stężenie procentoweSTĘŻENIE PROCENTOWE Zadanie 465 (2 pkt) Obliczyć stężenie procentowe
więcej podobnych podstron