img042 (2)

0upł<** DfU
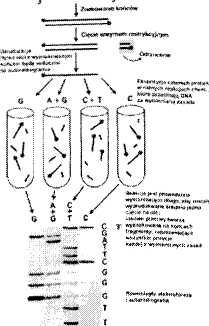
Metoda Maxama-Gilberta
(metoda chemicznej degradacji)
metoda opracowana w latach 1976-77
wymaga znakowania radioaktywnego (32P) na 5' końcu DNA
degradacja cząsteczek DNA związkami chemicznymi przecinającymi wiązania fosfodiestrowe za nukleotydem odpowiadającym określonej zasadzie
zbiór fragmentów DNA o różnej długości, które rozdziela się elektroforetycznie i poddaje autoradiografii
prążki na autoradiogramie odpowiadają fragmentom DNA posiadającym na końcu 3' określoną zasadę
Metoda Sangera
(metoda terminacji łańcucha)
Opracowana w 1975r.
0
1
O —-PratO
ó
i
O—P—O
I
0
1
■-0“P«»O
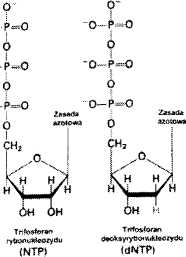
Tiltosforan
di<»«ok*yrybonukl«o*ycni
I ddNTP}
•' Zasad*
Ó azotowa
Zalety: niska toksyczność odczynników, relatywnie prosta i wiarygodna
Wymaga: matrycy w postaci jednoniciowego DNA, startera, polimerazy DNA, nukleotydów (dNTP) oraz dideoksynukleotydów (ddNTP)
ddNTP - hamują elongację łańcucha DNA z powodu braku grupy 3’-OH
Metoda Maxama-Gilberta
(metoda chemicznej degradacji)
Figuro 4A.4 Seąuencing an oliganocleotide by the Maxam-Gi!bort method
Q Eleclropnorosis © hadioautography
Sarapte ONA
Preparatipn o1 hofnpgeneous Kingfe-stirond DNA
Q Actdition of s;: P as 5' phosphale
Q Ctoovnge at specific ruicteołkJcs
! (3 toaction A reactlon. j T reaclkm, with some [willi some j-G cl«*vagc j C cf«avnge i (imaeri i n<Kf^ (undOrllned)
Fragmońt
lehgth : «»»«*> *
W hol* *.........
ollgomicuiotfd* -zalety: metoda niewrażliwa na trudne sekwencje (np. bogate w pary GC, modyfikacje epigenetyczne - metylacja)
wady: skomplikowana, stosowanie toksycznych odczynników, zakaz stosowania w komercyjnych zestawach
f Fead soguence
Metoda Sangera
(metoda terminacji łańcucha)
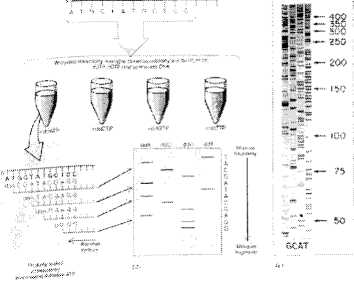
• Produkty każdej z czterech reakcji rozdziela się elektroforetycznie w żelu poliakrylamidowym w warunkach denaturujących
• Wizualizacja fragmentów za pomocą ekspozycji żelu z kliszą rentgenowską
Wyszukiwarka
Podobne podstrony:
Slajd50 Metoda Maxama-Gilberta Metoda praktycznie już nie stosowana. )••* prow*d#ons długo *by imMo
wbLd LI GZSSSlSHBHBBflBH -różnice w sekwencjonowaniu metodami Sangera i Maxama- Gilberta -jak przebi
IMG682 Cechy charakterystyczne • Metoda opracowana przez I. Rechenberga i
17587 S1050582 (2) METODA OWAS (Ovako Posturę Analysing System) Pierwsza wersja została opracowana w
CYKL SZKOLEŃ Z ZAKRESU WSPOMAGAJĄCYCH I ALTERNATYWNYCH SPOSOBÓW POROZUMIEWANIA SIĘ (AAC) Metoda opra
Współczynnik podziału R-l Równowagi fizyczne i chemiczneR-1WSPÓŁCZYNNIK PODZIAŁU (opracowała
3. MATERIAŁ I METODA OPRACOWANIA Materiałem do niniejszego opracowania są różnorodne informacje,
AMPLIFIKACJA FRAGMENTU DNA METODĄ PCR Technika PCR (ang. polymerase choin reacdon), opracowana w lat
Kanban - opracowana w latach pięćdziesiątych w Japonii metoda sterowania produkcją. Słowo Kanban w w
AGHWażniejsze metody oceny ekonomicznych skutków wypadków przy pracy Metoda opracowaną przez A. Hebd
więcej podobnych podstron