P5101345
I Praykbuiowa reakcja i udziałem katalizatora:
woda utleniona - rozkład katalizowany przez:

Stały MnO,
I kataliza heterogeniczna
roztwór wodny Fet .l kataliza homogeniczna
woda utleniona roztwór Htł*0, Jako inhibitor, czyli spowalniacz reakcji rozkładu
J Jak na wykresie przedstawić fakt, żc katalizator zwiększa szybkość reakcji chemicznej?
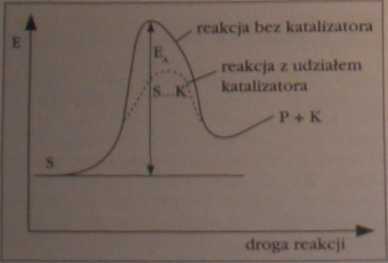
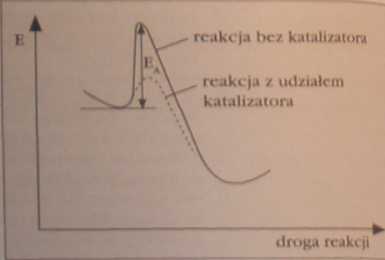
Tworzy się przejściowe połączenie substrat-lutallzator (co przedstawiono tylko na Jednym z powyższych wykresów), z czego powstają produkty i odtwarza się katalizator. Katalizator ma więc wpływ na wielkość energii aktywacji reakcji.
Podstawowe zagadnienia równowagi chemicznej
Jeżeli Jeden z produktów reakcji chemicznej opuszcza układ reakcyjny w postaci gazu, to reakcja la aa pewno przebiega do końca w prawo, czyli do całkowitego wyczerpania substratów. Można ją określić tako praktycznie nieodwracalną W równaniu reakcji ten fakt należy zaznaczyć strzałką skierowaną w jedną,prawą stronę - -* Większość reakcji chemicznych - w odpowiednich warunkach - przebiega w sposób tKlwracalny. Jeżeli reakcja przebiega w układzie zamkniętym i Jednorodnym (w stanic gazo wym lub ciekłym oraz nie następuje zmiana parametrów fizycznych układu) dostatecznie długo, to mula się stan równowagi dynamiczne). Ten stan charakteryzuje się tym, że stężenia reagentów w jednostce czasu nic ulegają zmianie pod warunkiem, że nie zmieniają się czynniki wpływające na szybkość reakcji. W rownaniu reakcji ten fakt zaznaczyć należy dwoma strzałkami przeciwnie skierowanymi.
iniUlU)^ jednoetapową reakcję odwracalną, dla której /oital osiągnięty Man równowagi, przedstawioną i ,|„isob ogólny poniższym schematem:
v.
aA + bB a =*=* cC + dl)
V,
skład układu opisać prawem działania nuw:
K
eon sl.
K. stężeniowa siała równowagi chemicznej - jest to wielkość siała w danych warunkach temperaturo wycli I niezależna od wartości początkowych stężeń substratów |A|,|B|,[C|,|I)| - równowagowe stężenia molowe reagentów
Jak Uczyć równowagowe liczby moll reagentów?
Zakładamy, że:
• Hibstraiy zostały zmieszane w stosunku molowym 1: 2,
• reakcja przebiega według równania: 2 A + B ■ A,11,
• otrzymano y moli produktu.
|
stan początkowy (liczba moli) |
ilość przcrcagowanrgo subatratu, Ilość otrzymanego produktu (Uczba moli) |
stan równowagowy (liczba moll) | |
|
lubitnt A |
1 |
2y |
1 -2y |
|
nihstratb |
2 |
y |
2-y |
|
produkt Ajlł |
y |
y .••aa |
Wartość stałej równowagi zależy od sposobu określenia składu mieszaniny reagentów, np. stężenia molo we (stężeniowa stała równowagi), ciśnienia cząstkowe (ciśnieniowa stała równowagi).
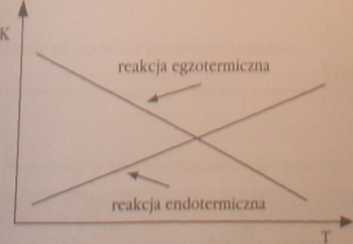
Stała równowagi reakcji zależy od temperatury:
Prawo działania mas: w stanie równowagi stosunek iloczynu stężeń produktów podniesionych do od powiednich potęg do Iloczynu stężeń substratów podniesionych do odpowiednich potęg jest wielkością stałą wdanej temperaturze.
Kinetyka I równowaga (lumkuu 197
Wyszukiwarka
Podobne podstrony:
P5101345 I Praykbuiowa reakcja i udziałem katalizatora: woda utleniona - rozkład katalizowany przez:
Rozpad ozonu następuje w wyniku reakcji z udziałem katalizatora (X), którym może być chlor, tlenek a
P4160899 Transkrypcja RN A jest reakcją polimeryzacji, katalizowanej przez enzymy zwane polimerazami
052 2 83. Poniższa reakcja jest katalizowana przez: HO. % C ch2 OH + GTP + GDPV0H H,C OH -p=o OH +
reakcje z wodorem M + H; =MH; stopień utlenienia wodoru: -I. metalu II wodorki w reakcji z woda dają
Samsung SCX 6x22 Series 091118164909 1 Rys.1.2. Zmiany anergll w czasie biegu reakcji egzotermicznej
Spis treści 22.3. Nadwrażliwość typu III - reakcje z udziałem
P1100378 ZWIĄZKI O DZIAŁANIU PRZEOWDROBNOUSTROJOWTM2. NIEORGANICZNE: H202 <— woda utleniona/ nadt
IMG 75 woda utleniona h2o2 katalaza w małej probówce Rys. L9jj zbierający się tlen ii h2o Oceń i
13495 Obraz 7 (25) IM Podobnie jak hydroliza estrów, hydroliza amidów jest katalizowana przez kwasy
więcej podobnych podstron