skanuj0051 (24)

104 4. SUieniarort worów
Przykład 24 . . , ^ ^
Ile należy odparować wody z 320 g 15% roztworu C0SO4, aby otrzymać roztwór 40%?
Rozwiązanie
Cj= 15%; m,i=!320g; cj = 40%; m* - (320 - x) g; c* = 0%; m,2Bxg; m,rc, + m,2-C2 ■ (nvi + m^cj =* (320 - x>40 + x-0 - 320-15 x=320(40 -15)/40 = 200 g Należy odparować 200 g wody.
Zmniejntrń* stężenia roztworu można osiągnąć:
- dodając roztwór bardziej rozcieńczony (przykład 19);
- dodają* rozpuszczalnik.
Przykład 25
He należy dodać wody do 250 g 40% roztworu ZnCl>, aby otrzymać roztwór 14%? 'X‘-
Rozwiązanie
ca-14%; mfJ = (250 + x)g; C|-40%; m„-250g; cj-0%; m*- xg; m,i-ęitnirrCa-(m»i +m^jcj ^250-40+x-0==(250 + x>-14
__„_-x - 250(40 -vl.4)/14 - 4Ó4a e ____I___
mm'" Należy dodać 464,3 g wody. IBM ' " ’!r7 ‘
Przykład 26
Ile cmJ Oho = 30% roztworu HCl o gęstości dna - 1,150 g/cmł należy użyć do przygotowania 0,50 dm3 0,20 molowego roztworu HCl? Mho “ 36,47 g/raol. Rozwiązanie — •, .. >_•
-Potrzeba: 0,50 dm30,20 mol/dm3 = Orf 0 moli HC!?Należy obliczyć, w jakiq objętości dostępnego roztworu kwasu solnego znajduje się taka ilość moliHCl ;’w nHci = 0,100 mol = Yhci^hci^hc/CIOO ^hci)
= x-l,150 g/cm3-30/(100-36,47 g/mol) x-10,57 cm3 >.
Należy wprowadzić 10,57 cm3 posiadanego roztworu HCl do kolby miarowej na 500 cm3 i uzupełnić wodą do kreski.
4.8. Zadania
1. Solanka kopalniana zawiera 13,5% soli. Ile soli można otrzymać po odparowaniu 5 kg tej solanki? - •
2. Ile amoniaku znajduje się w 300 cm3 20% roztworu NHj, którego gęstość

wynosi 0,923 g/cm5?
3, W jakiej objętości 45% roztworu HNO3 o gęstości 1,28 g/cm3 znajduje się
0,25 mola tego kwasu? MHNq3 = 63 g/mol.
4. Ile gramów KOH oraz wody należy odważyć w celu przygotowania 120 g 4% roztworu wodorotlenku potasu?
5. Ile g kwasu borowego można uzyskać w wyniku odparowania 80 g 2 mołal-nego roztworu H3BO3? MHjBOj=61,83 g/mol.
6. Jaką ilość gramów NiSO^THiO należy użyć do przygotowania 320 g 8%
roztworu NiSO*? 280,88 g/mol, MMSq4 “ 154,78 g/mol.
7. W 400 g roztworu zawartych jest 160 g NaOH. Wyrazić stężenie NaOH w procentach molowych. M^on ~ 40 g/mol, Młł?0= 18 g/mol.
_8 Ile {^AlCl*znajduje się w. 0,12 kg 8% roztworu?— -------»--
9. Stosunek liczby moli wodoru: azotu w roztworze gazowym do syntezy NHj wynosi 3:1. Wyrazić skład tego roztworu w procentach objętościowych.
10. Ile wynosi masa atomowa niklu, jeśli rozpowszechnienie w przyrodzie jego trwałych izotopów jest następujące: 58Ni (67,9%), *°Ni (26,2%), 6lNi (1,2%),
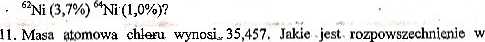
przyrodzie dwóch jego trwałych izotopów o liczbach masowych 35 i 37?
12. Zawartość telluru w litosferze oceniana jest na 2-10_7%. Wyrazić tę zawartość
w ppm i ppb.
13. Zawartość germanu w popiele po spaleniu pewnego gatunku węgla wynosi 400 ppm. Obliczyć jaka jest procentowa zawartość Ge w tym węglu, jeśli podczas spalania daje on 10 % popiołu.
Wyszukiwarka
Podobne podstrony:
22013 skanuj0053 (24) 104 4. Stężenia roztworów Przykład 24 Ile należy odparować wody z 320 g 15% ro
skanuj0022 (24) 178 4. DYNAMIKA MASZYN I MECHANIZMÓW Z CZŁONAMI SZTYWNYMI = 360,167, ff?4 = 328,167,
skanuj0180 Specjalne detale architektoniczne 179 Przykład: Połączenie ścian o grubościach 38 cm i 24
70706 skanuj0022 (24) 178 4. DYNAMIKA MASZYN I MECHANIZMÓW Z CZŁONAMI SZTYWNYMI = 360,167, ff?4 = 32
skanuj0001 (11) Układy f x + y + z = O c) j 2x — y— z — -3 l x-y+ z = O Przykład 3.24 Rozwiązać
43631 skanuj0100 (24) Rozdział 4.4 Rys. 4-8. Przykład prawidłowo oznakowanej cysterny Kolejnym typem
skanuj0017 (24) stąd otrzymamy N} = G] cos 60°, r, =/iiVj =/iGjCos60o. (D-18.10) G
więcej podobnych podstron