Obraz17 (6)

OH
CO
.o.
ŃgOH
- utUnianl* rolnych związków organicznych za pomocą powietrza, tlenu lub innych czynników utleniających,
- wprowadzenia COs do cząataozkl związku organleinego,
- wprowadzania co do cząataozkl związku organicznego lub nieorganicznego,
- hydrolizy autru.
5-14.2. Przykłady procaaow przeoyełowych
Metody otrzymywania niektórych kwaeOw karboksylowych omówiono wcześniej, np. p. 4.16 i 5.9.
W podwyższonej temporaturze i pod zwiększonym cienieniem fenole i aminofenol# w postaci fenolanOw (sodowych czy potasowych) oraz naftolany sodowe reagują z ditlenkiem węgla z wytworzeniem aromatycznych kwasów karboksylowych. Reakcje to wykorzystuje alg ra.ln. do otrzymywania kwasu salicylowego, p-hydrokeybenzoesowego i p-amŁnoeelicylowego.
Otrzymywanie kwasu salicylowego metodą Kolbego-Schmitta
W przemyśle kwas salicylowy (temp.'' topn. 159°C) otrzymuje się przez działanie na fenolan sodowy ditlenkiem węgla pod zwiększonym ciśnieniem. Proces przebiega w dwóch etapach, przy czym w drugim otępię następują przegrupowanio węglanu fenolowo-sodowogo do salicylanu uodowogoi
ONo O-C-ONc
90-i30‘C l30riaQ-C
(Oj + C02 0SMPO (Qj 08MP
Oo stalowego autoklawu wyposażonego w węźownicę i mieszadło wlewa się Stopiony fenol 1 dobrze mieszając dodaje aię etachiometryczną iloec ługu sodowego. Ogrzewanie pod zmniejszonym ciśnieniem usuwa wodę za arodowieka reakcyjnego, przy czym fenolan rozpada aię wtedy na proszek. Do odwodnionego, rozdrobnionego fenolanu eodowego doprowadza aię ditle-nek węgla początkowo pod cienieniem ok. 0,5 MPe. Reakcja jest egzotermiczna i mieszaninę reakcyjną chłodzi się wodą przepływającą przez węiownicę. Następnie kontynuuje się dodawanie dltlenku węgla pod ciśnieniem 0,8 MPa. Wtedy temperatura mla.zanlny reakcyjnej podwyższ, się i następuje przegrupowanie produktu pośredniego do salicylanu sodowego. Po .twierdzeniu, tm oasa reakcyjna nie pochłania wigeej C0a, zmniejsza się ciśnienie i mesę poreakcyjną ługuje elf gorącą wodą. Przez przedmuchanie roztworu przegrzaną parą wodną oddziel. al« ni. przeraago-wemy fenol. Kwa. aalicyłowy wydziale aig * roztworu aoll aodowej przaz
zakwaszenia kwasem siarkowym. Po odsączaniu, przsmyciu . wyi rowy produkt oczyszcza się przaz aublimację. •
otrzymywania kwaau p-hydrokaybenzoesowago
Kwas p-hydroksybenzoesowy (temp. topn. 214°C) otrzymuje się podobnia jak kwas salicylowy, przy azym w tym przypadku działa aię ditl«nki#m węgla na fanolan potasowy w temp. 220-240°Ci

COOK
ester metylowy kwasu p-hydroksybenzoesowego (nipagine) o tamp. topu. 128-131°C stanowi .rodak konaarwujący i sntyaeptyczny atosowany w prze-mysia farmacautycznym i spożywczym. Podobne włstciwoicl wykazują inn# estry, np. stylowy i propylowy. Ester metylowy [ataptlna H), ester stylowy (asepcJna i) i eutar propylowy (asapcins P) są środkami o działaniu bakteriobójczym 1 bakterloetatycznym, stosowanymi w lecznictwie do przyrządzania preparatów farmaceutycznych, np. maici, kropli, roztworów do wstrzykiwali.
Otrzymywanie kwasu p-aminosalicyiowego
Kwas p-aminosalicylowy (tamp. topn. 142°C) powstaje w reakcji •-aminofenolu z ditlenkiem węgla wobec wodorowęglanu potasowego:
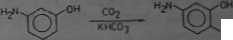
COW
Kerbokeylowanie prowadzi aig w roztworze wodnym, w tamp. 90°C. g ciśnieniem 3 MPa. Kwas ten stanowi znany środek prraciwgrutiiczy I działaniu bakterioatatycznym, tzw. PAS (l.Lehman. 1946 C.) podawamy doustnie w mieszaninie z innymi lekami, np. streptomycyną.
Otrzymywanie kwasu mrówkowego 1 jego soli sodowej
Mrówczan sodu pow.taje w wyniku reakcji wodorotlenku sodu z tlenki-węglai
-» HCOOMo .
R..KGj. pr.«bi.9. w t«p. US-liO-C, pod ci.ni.ni.. NP.. . «to-
U.wi. ..op.tr.ony. - I-—* ‘ •““» +
09.uw.oi. -i....oi»y rutoyin.1. . po... do J.j obi-.....- |
4M
632
Wyszukiwarka
Podobne podstrony:
PLAN STUDIÓW zarządzaniu organizacjami za pomocą metod i
Rozdział 21 Rys. 12. Schemat reakcji derywatyzacji związków karbonylowych za pomocą PFBOA. Jest to m
Polega na utlenieniu subst.organicznych za pomocą mocnych kwasów mineralnych (HN03, H2S04, K.C104) l
gQ2 związków organicznych zwanych fenolami o wzorze ogólny Ar-OH. Najpro nich nosi nazwę fenolu.Naze
ALKOHOLE I ETERY ALKOHOLE Alkoholami nazywane są związki organiezne zawierające grupę hydroksylową -
2 (43) 2 Technologie łączą silne związki z organizacją i ekonomiką procesów wytwórczych, co znajduje
Fotosynteza Związki organiczne organizmów autotroficznychprzyrod.co. CO, Podetrze i woda▲
Lista 1 Cw 1 Przykłady do Ćwiczeń nr 1 1. Znajdź w literaturze zasady nazewnictwa związków organiczn
DSC00931 2 MINERALIZACJA : V <>*U /"to, ZWIĄZKI ORGANICZNE tlenowi BUTWIEMIE s H,0, co,
CO GRZEBIEW GLEBIE Od rodzaju gleby, jej struktury i zawartości związków organicznych zależy, jakie
gR9 EltllY Eterami nazywa się związki organiczne, w których atom tlenu związany jot z dwiema resztam
Img00233 237Azot 4.52. Azot N2 jest gazem niepalnym, nietoksycznym, słabo rozpuszczalnym w związkach
więcej podobnych podstron