Picture�8 (4)

20
l.y
i

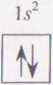
Atom helu He ma 2 elektrony, które lokują się w orbitalu b. Mają one spiny antyrównoległe. Jego konfigurację zapisuje się jako b2:

Atom litu Li ma 3 elektrony, 2 nasycają orbitale b, a 1 lokuje się w orbitalu 2.v. Jego konfiguracja jest następująca: b22.y'.

2s'
Konfiguracja atomu węgla C przy 6 elektronach w stanie podstawowym przedstawia się następująco: \s22s2p2. Zgodnie z regułą Munda 2 elektrony 2p1
znajdują się na dwóch różnych orbitalachp. Można to zapisać: \s22s22p\2p\ .
l.y2 2s2 2pĄ

Konfiguracja atomu wapnia Ca (20 elektronów) przedstawia się następująco: \sW2p63s23pb4s2.
|
2s2 |
2P6 |
3.y2 |
3 Pb |
4i2 | ||
|
łł |
tł |
W |
tł |
W ti łł |
N |
Ze wzrostem liczby elektronów orbital 3d ma wyższą energię niż orbital 4.v. Orbita! 4,v jest zajmowany przed 3d. Podobnie orbital 5.v jest zajmowany przed 4c/. Stąd konfiguracja elektronowa np. żelaza (26 elektronów) jest następująca:
1.v22.v22//’3.v23//'4,v23ż/6 lub:
|y
2ł
V
3.v
3 d6
4.y'
|
Al Ty |
W |
w |
A Ty |
|
tł |
ti |
fł |
W |
|
ii Ty |
A |
A |
t |
A |
W
powloką K powloką /.
a-l n- 2
powłoka M
n = 3
powłoka N n I
1.4.3. Kształty orbitali atomowych
Prawdopodobieństwa napotkania elektronu w danym elemencie pr/csti -obrazują przedstawione poniżej na rysunkach kształty (powierzchnie) orb atomowych. Orbitale s mają kształt kulisty:
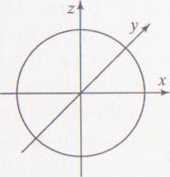
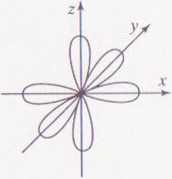
Orbitale p mają postać hantli ułożonych wzdłuż osi x,y, z układu wspóli/ nych. Ustawione są w przestrzeni w stosunku do siebie pod kątem prostym
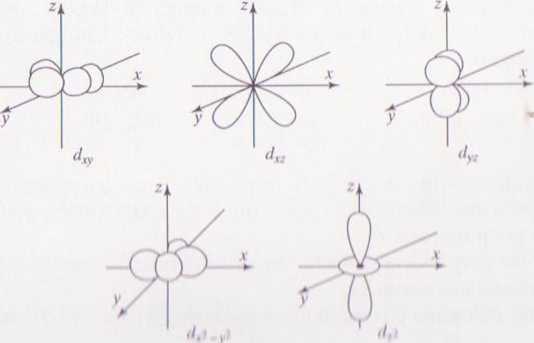
Orbitali d jest łącznie 5 i mają bardziej skomplikowane postacie:
Wyszukiwarka
Podobne podstrony:
PA130255 Pierwsza transformacja pojęcia • Atom ma części, które dają się wydz
image10 Co to jest rok? He ma miesięcy? O tym dowiesz się od dorosłych lub z obrazków. Wyjrzyj przez
Picture252 Tasiemiec pasożytujący ponad 30 gatunków ssaków, które odżywiają się surowy miJ&
DSC00323 (20) Lepkosprężystość Płyny lepkosprężyste to takie, które charakteryzują się składową
Obraz (1799) 176 Rob amoniaku w redukcji Bircha polega na wytwarzaniu tzw. solwatowa-nych elektronów
Obraz (1799) 176 Rob amoniaku w redukcji Bircha polega na wytwarzaniu tzw. solwatowa-nych elektronów
image10 2 • Co to jest rok? He ma miesięcy? O tym dowiesz się od dorosłych lub z o
DSCN2173 (2) Elektrony, które znalazły się na wolnych orbitalach w paśmie walencyjnym tworzą tzw. ga
20(3) 3 rPostaw zieloną kropkę przy przedmiotach, które znajdują się w Twoim domu, podpisz ilustracj
2tom196 5. MASZYNY ELEKTRYCZNE 394 trójfazowej, jak i jednofazowej. Mają one symetryczne uzwojenie t
Atom tej domieszki ma trzy elektrony walencyjne, związane z sąsiednimi atomami krzemu. Do wypełnieni
magnetycznego, które rozchodzi się jako fala elektro ma gnety c zna. - skutek prze
więcej podobnych podstron