s 73
73
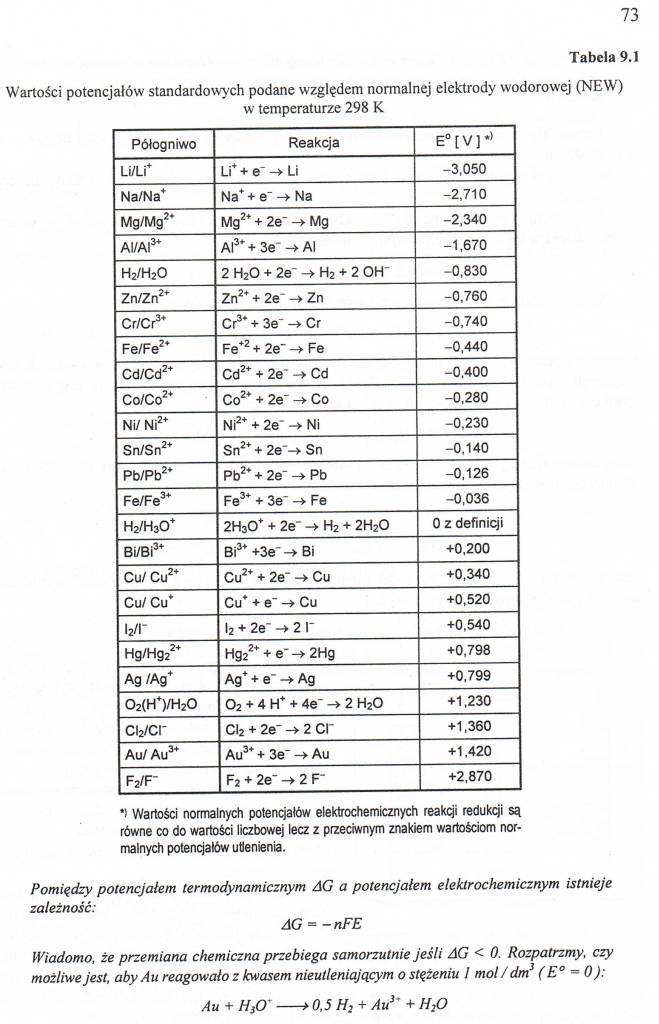
Wartości potencjałów standardowych podane względem norm w temperaturze 298 K
Tabela 9.1
vej (NEW)
|
Pólogniwo |
Reakcja |
E°[V]*> |
|
Li/Li* |
Li* + e' -> Li |
-3,050 |
|
Na/Na* |
Na* + e" -► Na |
-2,710 |
|
Mg/Mg2' |
Mg2* + 2e~ -> Mg |
-2,340 |
|
AI/AI3* |
Al3* + 3e" -> Al |
-1,670 |
|
H2/H20 |
2 H20 + 2e- -+ H2 + 2 OH" |
-0,830 |
|
Zn/Zn2* |
Zn2* + 2e" -» Zn |
-0,760 |
|
Cr/Cr3* |
Cr3* + 3e‘ -» Cr |
-0,740 |
|
Fe/Fe2* |
Fe*2 + 2e" -> Fe |
-0,440 |
|
Cd/Cd2* |
Cd2* + 2e‘ ->Cd |
-0,400 |
|
Co/Co2* |
Co2* + 2e* -» Co |
-0,280 |
|
Ni/ Ni2* |
Ni2* + 2e- -* Ni |
-0,230 |
|
Sn/Sn2* |
Sn2* + 2e"-> Sn |
-0,140 |
|
Pb/Pb2* |
Pb2* + 2e" -» Pb |
-0,126 |
|
Fe/Fe3* |
Fe3* + 3e- -* Fe |
-0,036 |
|
H2/H3O* |
2H3O* + 2e" -+ H2 + 2H20 |
0 z definicji |
|
Bi/Bi3* |
Bi3* +3e" -> Bi |
+0,200 |
|
Cu/ Cu2* |
Cu2* + 2e" -* Cu |
+0,340 |
|
Cu/ Cu* |
Cu* + e‘ -> Cu |
+0,520 |
|
l2/r |
l2 + 2e- 2 r |
+0,540 |
|
Hg/Hg22‘ |
Hg22* + e-^2Hg |
+0,798 |
|
Ag /Ag* |
Ag* + e" -> Ag |
+0,799 |
|
02(H*)/H20 |
O2 + 4 H* + 4e‘ -» 2 H2O |
+1,230 |
|
CI2/CI- |
ci2 + 2e- -► 2 cr |
+1,360 |
|
Au/Au3* |
Au3* + 3e~ -> Au |
+1,420 |
|
f2/f- |
F2 + 2e- 2 F“ |
+2,870 |
*1 Wartości normalnych potencjałów elektrochemicznych reakcji redukcji są równe co do wartości liczbowej lecz z przeciwnym znakiem wartościom normalnych potencjałów utlenienia.
Pomiędzy potencjałem termodynamicznym AG a potencjałem elektrochemicznym istnieje zależność:
AG=-nFE
Wiadomo, że przemiana chemiczna przebiega samorzutnie jeśli AG < 0. Rozpatrzmy, czy możliwe jest, aby A u reagowało z kwasem nieutleniającym o stężeniu I mol/ dm3 (E° = 0): Au + H30'-* 0,5 H2 + Au1’ + H2Q
Wyszukiwarka
Podobne podstrony:
17087 Obraz (2562) 176 Zmieniając wartość potencjału elektrody rtęciowej (względem elektrody odniesi
Przedstawiona tabela ma swoje praktyczne znaczenie. A mianowicie wartość potencjału standardowego
Obraz (2562) 176 Zmieniając wartość potencjału elektrody rtęciowej (względem elektrody odniesienia)
chemiac3 3 c Uzasatintc wynik posługując się wartościami potencjałom standardowych rcdoks, Doświadcz
Potencjał standardowy - (dawniej potencjał normalny) skala potencjałów względem
73 WARTOŚCI W CZASOPISMACH MŁODZIEŻOWYCH nych i w przypadku sporów światopoglądowych. Często
69371 IMGf18 (4) TimeryAiczniki 73 Wartość zliczona Wartość odniesienia _ji_n_n_n_ Zsynchronizowany
-.....-73 5. Podkreśl Ir informacje podane niżej, które odnoszą się do obowiązków ubdo. a) zapew nia
-.....-73 5. Podkreśl Ir informacje podane niżej, które odnoszą się do obowiązków ubdo. a) zapew nia
DSC 73 Wartości pożądane parametrów lipidowych (1,7 mmoi /1) Trigltcerydy < 150 mg/dl mg / dl: 88
Zdj 25252525EAcie0967 I •••**-■ ■ I •••• I ••••I «•»» Wartości potencjałów redoks wyznaczone w
więcej podobnych podstron