skan0312
Elektrochemia 315
gdzie
v =
to
co
exp
4 Dl
i ostatecznie
|
D |
1 X2 \ |
|
Tlt |
6XP I" 4Dt I |
[mol • m 2s ']
Wyniki obliczeń zestawiono w tabeli poniżej i wykreślono na rys. 6.7.
|
x, mm |
0 |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
0,6 |
0,7 |
0,8 |
0,9 |
1,0 |
|
Ig [-•/(*, 1)] |
-3,75 |
—4,83 |
-8,09 |
-13,5 |
-21,1 |
-30,9 |
—42,8 |
-57,0 |
-73,2 |
-91,7 |
-112 |
|
lg[-J(.r, 10)] |
-4,25 |
-4,36 |
-4,68 |
-5,23 |
-5,99 |
-6,96 |
-8,16 |
-9,57 |
-11,2 |
-13,0 |
-15,1 |
|
100)] |
-4,75 |
-4,76 |
-4,79 |
—4,85 |
-4,92 |
-5,02 |
-5,14 |
-5,28 |
-5,44 |
-5,63 |
-5,83 |
W polarografii do kapiącej elektrody rtęciowej (KER) przykłada się wolno narastający w czasie potencjał i rejestruje prąd elektrolizy (rys. 6.8).
Dla reakcji redukcji
(6.101)
Ox + ne Red
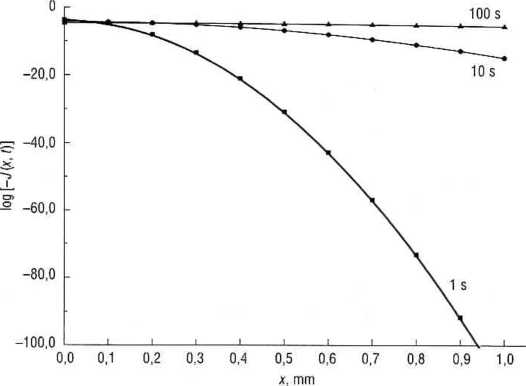
Rys. 6.7. Wielkość przepływów substancji w funkcji czasu i odległości od elektrody. ■
Wyszukiwarka
Podobne podstrony:
33 (45) SCHEMATY OBWODÓW WYPOSAŻENIA ELEKTRYCZNEGO 315 2 z* od ampki kontrolnej ładowania akumulator
248 NOWE W BIOCHEMII wego bądź całych atomów wodoru, bądź tylko elektronów. Tam, gdzie oksydoredukcj
skan0302 Elektrochemia 305 Rozwiązanie. Wprowadzając oznaczenie x = [Cl ]/c® możemy ułożyć 4 równani
skan0306 Elektrochemia 309 ^ ^o Gcd ^rcd ^ ox(6.88) i związana jest z gęstością pr
skan0316 Elektrochemia 319 Rys. 6.11. Chronowoltampcrometria: a) przyłożony do elektrody badanej imp
Elektra skrypt�2 ) gdzie: / — prąd płynący przez opornik (w przypadku prądu zmiennego wartość skutec
page0063 4co<0€44o scfat-dt i dc CcdiftstdtC dt* Cd Z*t/cdCf SCfó 4 ClI CC^
więcej podobnych podstron