skanuj0013

I

rci*->cir*ia
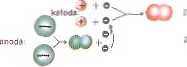
*' Model cłekłfDłizy kwaia dto>wdcw«p> HCL «J fncay port*(ijrt u budOr. pntiepMpe u iDodae
-fł,
imotoryczna (ego ogniwa wynosi 1,36 V. Dalszy (znacznie wolniejszy) wJrk napięcia powstałego ogniwa jest spowodowany praca, jaka odo wyko-'!«• /Ziając miernik. Wartość 1,36 V jest równa potencjałowi elektrodo-*11111 chloru, ponieważ potencjał wydzielania wodoru w środowisku kwaśni llin> przy/mu jemy za równy zero. A więc różne gazy, tak jak i metale, ipl swoje potencjały elektrodowe. Warunkiem wydzielania się okreflo-• h produktów na elektrodach Jest przyłożenie zewnętrznego napięcia •rwy/.i/ąjącego wartość SEM ogniwa, Jakie one tworzą.
W przypadku ogniwa wodorowo-chlorowego w środowisku kwaśnym •I ono przekroczyć wartość 1.36 V.
Vw*mlmiy chemiczne przebiegające na elektrodach — redukcja na miodzie I utlenianie na anodzie, pod wpływem przyłożonej z zewnątrz rptarciąjąco dużej różnicy potencjałów — nazywamy elektrolizą.
rm podczas elektrolizy kwasu chlorowodorowego na katodzie wydziela wodór a na anodzie chlor.
Kolejność redukcji kationów w procesie elektrolizy jest na ogół zgod-szeregiem potencjałów standardowych pólogniw. W pierwszym rzędzie kują hic kanony o dodatnich potencjałach, potem wodór, a następnie >ny o potencjałach ujemnych,
W procesie utleniania anionów na anodzie wydzielają się przeważnie produkty gazowe. Mają one swoje potencjały standardowe. Jednak ich potencjał wydzielania jest zmienny i zalety m.in. od pH roztworu, a także od materiału elektrody, na której się wydzielają i stanu jej powierzchni (gładka, czy rozwinięta). Dotyczy to również wodoru. W pierwszej kolejności utleniają się aniony o najniższych potencjałach, a następnie o coraz wyższych (rys. 7.16). **n«i*,» o

H,
7.16. Wykres potencjałów wydzielania
i ! Spróbujmy teraz dokonać analizy procesu elektrolizy wodnego roztworu NaCI. Znajdujące się w tym roztworze jony Na* wędrują do katody. Mają one jednak tak niski potencjał, że w rzeczywistości następuje redukcja wody z wydzieleniem wodoru:
2 H20 + 2e~ —#• 2 OH" + H2
Środowisko roztworu w pobliżu katody staje się zasadowe na skutek gromadzących się tam jonów OH". Na anodzie następuje wydzielanie chloru, podobnie jak podczas elektrolizy wodnego roztworu HCI.
A więc i w tym wypadku powstaje ogniwo wodorowo-chlorowe. Jednak potencjał wydzielania wodoru w środowisku zasadowym obniża się (patrz rys. 7.16) i SEM tego ogniwa wynosi: 1,36 - (-0,83 V) - 2,19 V. W porównaniu z ogniwem wodorcwo-chlorowym w środowisku kwaśnym (dośw. 7.4} SEM rozważanego ogniwa jest wyższa. Aby spowodować elektrolizę wodnego roztworu NaCI, należy przyłożyć znacznie wyższe napięcie, niż wymagała lego elektroliza wodnego roztworu HCI. mimo że w obu wypadkach produkty były takie same.
■ Podczas elektrolizy wodnego roztworu NaOH na katodzie wydziela się wodór, analogicznie jak w przypadku elektrolizy wodnego roztworu NaCI. Na anodzie natomiast następuje utlenienie jonów OH* z wydzielaniem tlenu:
4 Oli* —*■ 2 11,0 + O; + 4e
Wyszukiwarka
Podobne podstrony:
skanuj0013 I rci*->cir*ia * Model cłekłfDłizy kwaia dto>wdcw«p> HCL «J fncay port*(ijrt u
skanuj0040 (61) Pi>jia:u>a£i)l iMfauL pw/rfir^a ptoCtW pwJwCKWgjd&łkT j
skanuj0136 (5) 2K2 DldMOKM.IA EIYCZNA aktów władzy państwowej, społecznych zwyczajów i instytucji, w
skanuj0141 PODSTAWOWE WIADOMOŚCI O ASERTYWNOŚCI MODEL
skanuj0117 (7) 2.W AKSK.HM.IA I I Yt /NA cja. która jednak tkwi w strukturze moralnej tego aktu, sta
więcej podobnych podstron