skanuj0009

Do 5 probówek odmierzyć podaną w tabeli I objętość ekstraktu z ziemniaka, benzydyny,
KCN i H2O. Do probówki nr 4 dodać zagotowany ekstrakt. Zawartość probówek wymieszać i postawić na 20 min. w temperaturze pokojowej Obserwować zachodzące zmiany i zanotować wyniki.
Tabela I. Wykrywanie aktywności peroksydazy
|
Próba nr |
Wyciąg ml |
Woda ml |
Benzydyna ml |
KCN ml |
H202 ml |
|
1 |
2,5 |
0 |
0,1 |
0 |
0,1 |
|
2 |
2,5 |
0,1 |
0 |
0 |
0,1 |
|
3 4 |
2,5 |
0 |
0,1 |
2 krople |
0,1 |
|
2,5 |
0 |
0,1 |
0 |
0,1 | |
|
5 |
2,5 |
0,1 |
0,1 |
0 |
0 |
Wykrywanie aktywności oksydazy polifenolowej (EC 1.10.3.2)
Oksydaza polifenolowa przenosi wodór bezpośrednio na tlen cząsteczkowy. Substratami w tej reakcji są zwykłe fenole, które utleniają się do chinonów. Chinony kondensując dają barwne pochodne. Enzym jest metaloproteiną, zawierającą miedź.
Zasada:
Oksydaza polifenolowa utlenia pirokatechinę do chinonów, które kondensując dają ciemnobrunatne zabarwienie.
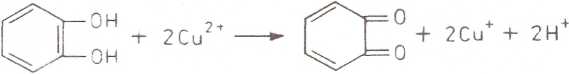
Pirokatechma o-Chinon
Wykonanie:
Do 5 probówek odmierzyć podane w tabeli II objętości ekstraktu z ziemniaka, wody, buforu, pi-rokatechiny i 4% roztworu NaCN. Do probówki nr 4 dodać ekstrakt zawierający termicznie zde-naturowane białka. Zawartość wszystkich probówek starannie wymieszać, zanotować czas i pozo-
Wyszukiwarka
Podobne podstrony:
skanuj0009 Do 5 probówek odmierzyć podaną w tabeli I objętość ekstraktu z ziemniaka, benzydyny, KCN
skanuj0023 3 Do roztworu SnCl2 dodajemy kroplami rozcieńczony NaOH. Pojawia się biały osad Sn(OHK Za
1) Ilość podana w tabeli potrzebna jest do okresowej wymiany oleju w misce i liltr
skanuj0017 Do podstawowych funkcji banków należy: • tworzenie pieniądza przez bank
skanuj0018 8. Do farmakologicznych metod hormonoterapii raka sutka należą: a. selektywne modulatory
skanuj0027 Do malowania odlewów lub dużych przedmiotów nieobrobionych stosuje się kredę rozrobioną w
skanuj0036 (8) Do osadu dodajemy po kilka kropli 6M NaOH i 3% H2O2. Całość ogrzewamy, a gdy utlenien
skanuj0130 Do budowy elementów i urządzeń automatyki stosuje się najróżnorodniejsze części konstrukc
więcej podobnych podstron