s che 1@

b) Jakie jest stężenie jonów hydromowych w tym roztworze?
c) Wytłumacz, dlaczego obecność cząsteczek NHj zmnigaza stężenie jonów HjO'7 Odpowiedzi:
1 - a “ 4,12%, a = 4,2%; 2 -c = 0,001 mol/dm\ pH * 11
3 - akceptorem protonów mogą być tylko ujemne jony 0J': O2- ■+ * OH*
4 - pH = 2, 69; 5 - c - 0,008 mol/dni3, pH = 2,l 6 - a) cząsteczka NH3 twarzy z HjO wiązania wodorowe;
b) pH = 11, a zatem c H3O* = 10 11 mol/dm3
c) cząsteczki amoniaku przyłączają protony pochodzące z wody:
NH> + HjO = NłV + OH", następuje więc zwiększenie Coh- i zgodnie z zależnością K = coK. * cHj(ł. automatycznie zmniejsza się stężenie jonów HjO\
10* HYDROLIZA
10,1. WPROWADZENIE TEORETYCZNE
Hydrolizą nazywamy reakcję soli z jonami wody. W wyniku tego procesu powstają produkty - kwas i zasada, z których dana sól powstała Reakcje hydrolizy możemy zapisać następująco;
NH4NO3 + HOll ^ NłŁOH + HNOi
Azotan(V) amonu reagując z wodą tworzy wodorotlenek amonu oraz kwas azotow><V). Jak widać na podstawie powyższej reakcji, hydroliza jest reakcją odwrotną do reakcji zobojętnienia;
NH*OH +HNO3 ^ NH4NO3 + H>0
Sole powstałe z silnych kwasów i silnych zasad nie hydiolizują, natomiast inne sole hydrolizują w różnym stopniu. Stosunek liczby cząsteczek soli, które uległy' hydrolizie da ogólnej liczby cząstek wprowadzonych do roztworu nazywamy stopniem hydrolizy.
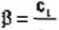
cT
gdzie;
fi - stopień hydrolizy,
C| - liczba cząsteczek soli, które uległy hydrolizie.
0} - ogólna liczba cząsteczek soli wprowadzonych do roztworu.
Reakcje hydrolizy są reakcjami odwracalnymi, dlatego możemy zastosować prawo działania mas Jeżeli da układu pozostającego w stanie równowagi chemicznej wprowadzamy dodatkowo jeden z produktów reakcji np. kwas lub zasadę, to przesuniemy równowagę reakcji w lewo, czyli cofhiemy hydrolizę. Z kolei dodając do układu więcej wody, możemy przesunąć równowagę w prawo, tj. zwiększyć stopień hydrolizy. Stopień hydrolizy zależy oó stężenia roztworu, temperatury i rodzaju soli Ze wzrostem rozcieńczenia stopień hydrolizy rośnie, podobnie wzrost temperatury wpływa na zwiększenie hydrolizy.
10,1.1. Hydroliza soli pochodnych mocny ch zasad i słabych kwasów
Octan sodu jest solą pochodną mocnej zasady i słabego kwasu Hydrolizuje on zgodnie z reakcją;
CHaCOONa * HOH ^ NaOH + CHjCOOH
Produktami tej reakcji są silna zasada sodowa, która jest całkowicie zdysocjowana oraz słaby kwas octowy, który w małym stopniu ulega dysocjacji elektrolitycznej W związku z tym odczyn roztworu tej soli po hydrolizie ulega zmianie. Najlepiej można zilustrować zmianę odczynu roztworu, pisząc reakcję hydrolizy CHjCOONa jonowo:
CHjCOO' + Na' + H20 ^ CH3COOH v Na + Olf
Wyszukiwarka
Podobne podstrony:
DSC01787 Stopień dysocjacji. Przykład: Jakie jest stężenie jonów CH3COO w 0.1 M roztworze CH3COOEL
P1050589 V IMK 0.1 mol l. należy obliczyć, jakie jest stężenie molowe jonów ce-nallU. 20 ml roztworu
Oblicz czy wytraci się osad Ag2S jeżeli 0,2 M roztwór AgNOj nasycam jakie będzie stężenie jonów
19) H2S jest słabym kwasem. Jak wpłynie na stężenie jonów S2 w jego roztworze
Kolokwium 2 zestaw 3 Zestaw III. I. • Jakie jest stężenie kwasu azotowego jeżeli dla wodnego roztwor
img010 19) H2S jest słabym kwasem. Jak wpłynie na stężenie jonów S2 wjego roztworze dodanie mo
DSC01788 Stopnień dysocjacjL Przykład: Jakie są stężenia jonów Ba24-i Cl w 0,Cb M roztworze BaCl2,
DSC01790 Stopnicń (hsocjacjL Przykład: Jakie są stężenia jonów Bał+i Cl" w 0,05 M roztworze BaC
Zadanie 44. Jakie może być maksymalne stężenie jonów Ag+ w 0,01 M roztworze NaCI? Iloczyn
img174 18. (5 pkt) Obliczyć stężenie jonów wodorowych i pH roztworu 0,18 molowego kwasu octowego (CH
22 ZADANIA Z CHEMII 4.9. Jakie jest stężenie molowe 35,0 % kwasu solnego o gęstośc
2) Oblicz stężenie jonów CH3COO‘ w 0,75 M roztworze kwasu octowego. pKa = 4,79 •
2011 10 27 43 03 Przykład 3 Obliczyć stopień dysocjacji a i stężenie jonów wodorotlenowych [OH ] w
16. ILOCZYN ROZPUSZCZALNOŚCI 7316. Iloczyn rozpuszczalności 16.1. Jakie jest stęże
więcej podobnych podstron