str043 (4)

84 Ćwiczenie nr 10
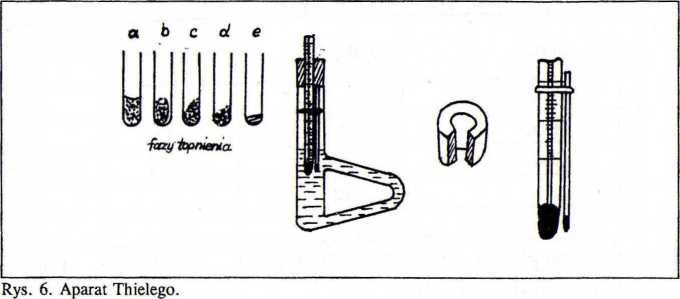
Sposób oznaczania temperatury topnienia (zadanie 5)
Metoda oznaczania temperatury topnienia polega na ogrzewaniu około 1 mg substancji w kapilarze o średnicy 2 mm, przymocowanej do termometru zanurzonego w odpowiedniej łaźni z cieczą i określeniu w jakiej temperaturze substancja ulega stopieniu. Zatopiona z jednego końca kapilarę napełnia sic dobrze sproszkowaną substancją tak aby jej warstwa miała 3-5 mm wysokości. Kapilarę przymocowuje się do dolnego końca termometru w taki sposób aby substancja znajdowała się pośrodku kulki z rtęcią (rys. 6). W tym celu wykorzystuje się napięcie powierzchniowe powstałe wskutek zwilżenia kapilary cieczą z łaźni. Przyciąganie kapilarne utrzymuje kapilarę na właściwym poziomie. W praktyce kapilarę przymocowuje się często za pomocą gumki. Termometr z kapilarą umieszcza się w łaźni tak aby kapilara była zanurzona do połowy swej długości (rys. 6). Najczęściej oznaczanie temperatury topnienia wykonuje się w aparacie Thielego. Można również oznaczać temperaturę w kolbie okrąglodennej z długą szyjką. Jako medium grzewcze stosuje się kwas siarkowy, który można ogrzewać do 250-280°C. Oprócz kwasu siarkowego można stosować parafinę (do 222°C) i odporny na wysokie temperatury olej silikonowy. Ogrzewanie medium grzewczego prowadzi się w taki sposób, aby temperatura wzrastała ze stałą szybkością 2-4 stopni na minutę. Jako temperaturę topnienia przyjmuje się temperaturę w której po zaokrągleniu i obtopieniu kryształów oraz pojawieniu się fazy ciekłej nastąpi moment, w którym cała substancja przejdzie w fazę ciekłą.
Przy oznaczaniu t, substancji nieznanej pierwsze oznaczenie wykonuje się z dużą szybkością ogrzewania aby uchwycić zakres temperatury topnienia, a drugie oznaczenie należy wykonywać według wyżej przedstawionego opisu.
2.5. TEMPERATURA WRZENIA
Jako temperaturę wrzenia cieczy przyjmuje się taką temperaturę, w której prężność pary nasyconej nad cieczą jest równa ciśnieniu zewnętrznemu w dowolnym punkcie na powierzchni fazy ciekłej.
Ciśnienie zewnętrzne może być ciśnieniem atmosferycznym 1013 hPh (760 mm Hg) lub ciśnieniem innych par czy gazów. Normalną temperaturą wrzenia (tj nazywamy temperaturę, w której zachodzi wrzenie pod ciśnieniem atmosferycznym 1013 hPa.
Ze wzrostem temperatury zwiększa się prężność par nad cieczą. Jak już wspomniano, gdy prężność par osiąga wartość całkowitą ciśnienia zewnętrznego zaczyna się wrzenie cieczy polegające na powstawaniu pęcherzyków pary w całej objętości cieczy. Następuje wówczas zahamowanie wzrostu temperatury. Dalsze dostarczanie ciepła z zewnątrz powoduje tylko wzrost prędkości parowania.
Dla czystych substancji ciekłych wyznaczona t„ przy P = 1013 hPa jest ściśle określona stała wartością. W tych samych warunkach t* cieczy zanieczyszczonej zależna jest od własności fizycznych zanieczyszczeń. Jeśli zanieczyszczeniami sa substancje nielotne, ciecz bedzie wrzeć w stałej temperaturze a zanieczyszczenia pozostaną w kolbie po oddestylowaniu właściwej substancji. W przypadku lotnych zanieczyszczeń temperatura wrzenia mieszanin będzie wzrastała aż do osiągnięcia temperatury wrzenia najmniej lotnego składnika.
W praktyce laboratoryjnej przy dysponowaniu większa ilością cieczy temperaturę wrzenia wyznacza się z dokładnością do 1-2 stopni, stosując metodę destylacji prostej.
Sposób oznaczania temperatury wrzenia (zadanie 6)
Dysponując minimalną ilością cieczy do oznaczania t^ stosuje się mikrometody. W metodzie Siwolobowa do pomiaru temperatury wrzenia używa się dwóch kapilar - jednej o długości 90-110 mm i średnicy 1 mm i drugiej o długości 80-100 mm i średnicy 4-5 mm. Każdą z kapilar zatapia się z jednego końca. W kapilarze o większej średnicy umieszcza się kilka kropel badanej cieczy i wprowadza się do niej cienką rurkę kapilarną zatopionym końcem do góry. Zestaw przymocowuje się do termometru i umieszcza w łaźni używanej do oznaczania temperatury topnienia.
W wyniku stopniowego ogrzewania aparatu z końca zanurzonej kapilary wydobywają się wolne pęcherzyki powietrza aż do momentu, kiedy ciecz osiągnie temperaturę wrzenia. Wtedy pojawia się szybki i ciągły strumień pęcherzyków gazu a odczytana temperatura odpowiada temperaturze wrzenia badanej cieczy. Należy wykonać przynajmniej dwa takie oznaczenia, a odczyty termometru nie powinny się różnić więcej niż o 1 stopień.
3. CZĘŚĆ DOŚWIADCZALNA
Zadanie 1,
Ocena wyglądu substancji organicznych.
Zapoznać się z substancjami organicznymi ciekłymi i stałymi. Zwrócić uwagę na barwę, postać (proszek, kryształy), konsystencję (gęstość), zapach. Przykłady substancji organicznych przedstawiono w tabeli 2.
Zadanie 2.
Obliczenie wzoru sumarycznego związku organicznego.
Ilościowa i jakościowa analiza elementarna wykazała, że związek ma wzór empiryczny CH. Zmierzona masa cząsteczkowa Wynosi 78. Jaki jest wzór sumaryczny tego związku? Przykład obliczeń przedstawiono w rozdziale 2.1.
Zadanie 3.
Wykonanie destylacji prostej.
Określić w próbce cieczy organicznej (paliwa) objętościowy udział frakcji wrzącej w przedziale temperatury 80-120°C. Posłużyć się zestawem aparatury do destylacji prostej. Destylację wykonać wg opisu podanego w p. 2.2. Podać jaka to frakcja ropy naftowej (zgodnie z tabela 1).
Zadanie 4.
Ekstrakcją substancji organicznej z wody za pomocą eteru dwuetylowego.
Określić zawartość substancji B rozpuszczonej w wodzie metodą ekstrakcji periodycznej. Ekstrakcję prowadzić rozpuszczalnikiem selektywnym w postaci eteru dwuetylowego. Zawartość substancji B obliczyć ze wzoru podanego w p. 2.3.
Wyszukiwarka
Podobne podstrony:
88614 str044 (4) 86 Ćwiczenie nr 10 Zadanie 5. Oznaczanie temperatury topnienia w aparacie Thielega.
72143 str045 (4) 88 Ćwiczenie nr 10 Tabela 4. Temperatura topnienia i wrzenia wybranych substancji
(22) Ćwiczenie nr 10 Prosty sposób wyznaczania ciepła parowania ]. Wiadomości ogólne Ogrzanie względ
75344 str040 (4) 78 Ćwiczenie nr 10 c) oznaczyć masę cząsteczkową związku, która określa rzeczywista
Ćwiczenie nr 10 Oznaczanie ryboflawiny w mleku. Do analizy otrzymałem dwie próbki mleka oznaczone nu
img032 (44) AKADEMIA TECHNICZNO-HUMANISTYCZNA w Bielsku-Białej Ćwiczenie nr 10
str039 (4) 76 Ćwiczenie nr 9 76 Ćwiczenie nr 9(10) a - ilość 0,05 m roztworu wersenianu sodu zużyta
str041 (4) 80 Ćwiczenie nr 10 mano przepływ wody. Destylacja ma zazwyczaj następujący przebieg: po p
1a PJWSTKLaboratorium techniki cyfrowej Sprawozdanie z ćwiczeń nr: 10 Temat: System przerwań Imię
Układ Krążenia0010 Ćwiczenia nr 10 Vffacf drążenia i jego funkcjonowanie (cz.l). 1. &nbs
więcej podobnych podstron