img243 (13)

15.2. Właściwości proteolityczne
Zdolność drobnoustrojów do hydrolizy enzymatycznej białek, polipeptydów, oligopeptydów oraz rozkładu aminokwasów została omówiona w podrozdziale 14.7.3. Poniżej przedstawiono najważniejsze, wykorzystywane w praktyce metody wykrywania produktów tych reakcji.
15.2.1. Hydroliza kazeiny
Kazeina - białko znajdujące się w mleku może - podlegać procesowi peptonizacji, tj. upłynniania w wyniku działania enzymów proteolitycznych bakterii. Zdolność drobnoustrojów do hydrolizy kazeiny sprawdzamy na płytce agarowej zawierającej 10% odtłuszczonego mleka. Po inkubacji płytki z bakteriami (37°C, 48 godzin) można zaobserwować przejaśnienia wokół kolonii świadczące o peptonizacji tego białka (wynik dodatni).
15.2.2. Upłynnianie żelatyny
Bakterie wytwarzające enzym - żelatynazę - hydrolizują żelatynę z wytworzeniem rozpuszczalnych w wodzie peptydów. Upłynniona żelatyna nic krzepnie w temperaturze pokojowej. Badanie zdolności bakterii do wzrostu i rozrzedzania żelatyny wykonujemy posiewając je na słupek żelatynowy (posiew „kłuty”) i inkubując w temperaturze pokojowej lub, jeżeli bakterie nic rosną w tych warunkach, to w temperaturze 37°C przez trzy dni. W przypadku bakterii nic wykazujących zdolności do hydrolizy żelatyny sprawdzamy typ ich wzrostu na słupku. Typy wzrostu hodowli kłutych w żelatynie oraz typy jej rozrzedzenia ilustruje rys. 15.1. W celu sprawdzenia, czy upłynnienie żelatyny w temperaturze 37°C nastąpiło w wyniku działania enzymu, czy też w następstwie inkubacji w wysokiej temperaturze, probówki z podłożem schładzamy w zimnej wodzie lub w lodówce. W przypadku enzymatycznego rozkładu żelatyny podłoże po schłodzeniu nie zakrzepnie.
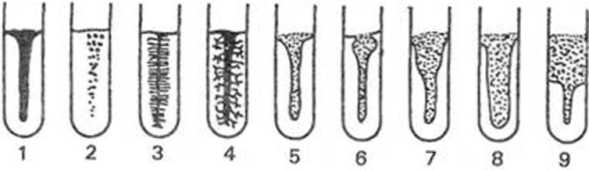
Rys. 15.1. Hodowle na słupku z żelatyną. Typy wzrostu: 1 - nitkowaty, 2 - oddzielne skupiska, 3 - rozgałęziony, 4 - drzewiasty. Typy rozrzedzenia: 5 - nicckowaty, 6 - miscczkowaty, 7 - lejkowaty, 8 - workowaty, 9 - warstwowy [4]
Wytwarzanie żclntyna/y przez bakterie można też sprawdzić posługując się hodowlą bakterii na płytce agarowej z 2% dodatkiem żelatyny. Po 24-godzin-ncj inkubacji podłoże z bakteriami zalewamy nasyconym roztworem siarczanu amonu lub chlorku rtęciowego w HC1 (odczynnik Fraziera). Wokół kolonii bakterii rozkładających żelatynę wystąpi strefa przejaśnienia, gdyż upłynnione białko nic ulegnie wytrąceniu pod wpływem wymienionych soli.
15.2.3. Badanie wytwarzania amoniaku
NH3 powstaje w trakcie procesów deaminacji aminokwasów. Wykrywamy go w hodowli bulionowej bakterii, umieszczając pod korkiem probówki z podłożem papierek lakmusowy. Zmiana jego barwy z różowej na niebieską, spowodowana alkalizacją środowiska w obecności NH3, świadczy o wyniku dodatnim.
Próba ilościowa opiera się na reakcji powstałego w środowisku wzrostu bakterii NH3 z odczynnikiem Nesslera (odczynnik jodowo-rtęciowy), który w środowisku alkalicznym reaguje z NH3, z wytworzeniem barwnego kompleksu (jodek amidoksyrtęciowy).
/Hg\
2K2(HgJJ + 3NaOH + NH3 —> 0( ;NH2J + 4KJ + 3NaJ 4* 2H20
Hg'
Ilość amoniaku można określić na podstawie intensywności powstałego zabarwienia. Barwa jasnożółta świadczy o małej ilości amoniaku. Zabarwienie brązowe o znacznej ilości, wypadnięcie brązowego osadu przemawia za bardzo dużą ilością NII3 w hodowli. W pełni ilościowe oznaczenie polega na pomiarze absorbancji próby badanej wobec roztworu wzorcowego (NH4C1 lub (NH^SOJ przy długości fali 430 nm.
15.2.4. Wytwarzanie siarkowodoru
H2S powstaje w wyniku rozkładu aminokwasów siarkowych (cystyny, cysteiny i metioniny). Enzym, który warunkuje ten proces - sulfhydraza
hydrolizujc wiązanie chemiczne pomiędzy grupą sulfhydrylową (SH) a resztą aminokwasu. Uwolniona grupa SH zostaje zredukowana do H2S w środowisku wzrostu bakterii.
Wytwarzanie siarkowodoru przez bakterie badamy na bulionie lub wodzie peptonowej oraz podłożach syntetycznych zawierających ww. aminokwasy. Obecność H2S w środowisku wzrostu bakterii sprawdzamy umieszczając w probówce (pod korkiem) z hodowlą pasek bibuły nasycony octanem ołowiu. Wydzielany H2S reaguje z tym związkiem chemicznym z wytworzeniem siarczku ołowiu, który zaczernia pasek bibuły.
Wyszukiwarka
Podobne podstrony:
22907 Slajd13 (182) MECHANICZNE WŁAŚCIWOŚCI MATERIAŁÓW — zdolność materiału do przenoszenia obciążen
IMG 07 Postawy chorobotwórczości • Chorobotwórczość-zdolność drobnoustroju do
(13) (15) dm = n(x)dx (3) Po podstawieniu (3) do (2a) oraz wyspecyfikowaniu sił Fy
Informacja do zadań 13.-15. Przeprowadzono doświadczenie: podczas którego do 10 cm" wodnego roz
DSCF4461 1 Inwazyjność - to zdolność drobnoustrojów do wtargnięcia do makroorganizmu, adaptacji
1. Wykorzystanie zdolności drobnoustrojów do degradacji zanieczyszczeń
apiP5 hodowlane II. Metody hodowlane Oparta jest na zdolności drobnoustrojów do wzrostu i rozmnażani
apiP5 hodowlane II. Metody hodowlane Oparta jest na zdolności drobnoustrojów do wzrostu i rozmnażani
IMG125 1 Cechy drobnoustrojów sprzyjające zakażeniom Zdolność adherencji do gładkich powierzchni (sz
SL275569 Właściwości lipidów Zdolność do rozpuszczania substancji smakowych i zapachowy
IMG 15 Różnica między temperaturą założoną, do wyznaczeniu średniego ciepłu właściwego spalin, a
więcej podobnych podstron