P5101272
Konfiguracja elektronowa to zapis przedstawiający przyporządkowanie elektronów atomu odpowiednim orbitalom atomowym W stanie podstawowym (tzn stanie o minimalnej energii) przyporządkowanie to odbywa pe zgodnie z następującymi regułami:
a) w atomach wie loc lok tronowych elektrony zapełniają orbitale atomowe według ich wzrastającej energii orbitalnej: Is 2s 2p 3* 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5/; ht zakaz Pauiiego w atomie wiełoelektronowym dwa elektrony nic mogą znajdować się w stanach opisywanych takimi samymi wartościami wszystkich liczb kwantowych. Każdy elektron w atomie musi różnił się od pozostałych wartością co najmniej jednej liczby kwantowej, np. ls2 - stan tych dwóch elektronów opisują następujące liczby kwantowe:
• n=l. I = 0.m = 0. mf= 1/2, t* 1/2,
i 111.110.m = 0, m,= -1/2. s * 1/2;
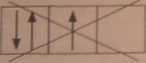
o regtda Bunda, podczas zapełniania orbitali zdegencrowanych należy kierować się zasadą, aby liczba elektronów niesparowanych była jak największa. Elektrony niesparowane mają jednakowy kierunek spinu. np.
n*
Konfiguracja elektronowa atomu w stanie podstawowym:
H ls22si2p'3s23pl
l^Cuj: (Ar| 4s' 3d'° lub - dozwolony dla pierwiastków bloku d i f zapis według wzrastającej wartości głównej liczby kwantowej - (Ar) 3dH> 4s'
Jak zjonizować atom?
• atom eirktrreznie obojętny-w kation jednododatni + oderwany elektron
Energia jonizacji: energia niezbędna do oderwania elektronu
- najłatwiej oderwać pierwszy elektron od atomu - pierwsza energia jonizacji; kolejne energie jonizacji rosną: trudniej oderwać elektron od już istniejącego kationu (E, < E, < E ...),
- Inowce mają najmniejszą energię jonizacji, a helowce największą (najtrudniej oderwać elektron od najkorzystniejszej energetycznie struktury),
- energia jonizacji ze wzrostem liczby atomowej pierwiastka w okresie rośnie, a w grupie maleje .
• atom elektrycznie obojętny + elektron -► jon ujemny
Powinowactwo elektronowe: energia wydzielona podczas przyłączania elektronu do atomu; im większe jest powinowactwo elektronowe (większa jest energia oddawana), tym „chętniej" atom przytacza elektron.
Układ okresowy pierwiastków
Współczesny układ okresowy stanowi uzupełnienie tablicy Mendelejęwa, a podstawą klasyfikacji jest liczba atomowa Z a dokładniej konfiguracja elektronowa pierwiastków.
Współczesny układ okresowy zawiera 118 pierwiastków; pierwiastek 110 uzyskał nową nazwę .Darmstadt i symbol Ds, natomiast pierwiastek 111 - nazwę .Roentgen" i symbol Rg.
Pierwiastki ułożone w kolejności rosnącej liczby atomowej tworzą siedem poziomych okresów oraz
18 kolumn (grup) o numerach od 1 do 18 (cyfry arabskie).
lantanowce i aktynowce zajmują odrębne miejsce w układzie okresowym
Pierwiastki należące do określone) grupy mają jednakowa liczbę elektronów walencyjnych liczba elektronów walencyjnych jest zgodna z numerem grupy - dla grup od 1 do 12; dla grup od 13 do 18 należy [_ od numeru grupy odjąć 10. Każda grupa obejmuje pierwiastki o analogicznych właściwościach chemicznych i częściowo fizycznych. Nazwy grup tworzy się od nazwy pierwiastka rozpoczynającego grupę, np. grupa I - litowce. grupa 2 - bcrylowce, grupa 17 - fluorowcc.
Pierwiastki należące do określonego okresu mają jednakową liczbę powłok elektronowych zgodną z numerem okresu. Dla pierwiastków grup 1,2113-18ostatnia
powloką jest powloką wakacyjna i stad numer okresu określa tę powłokę.
Współczesny układ okresowy wyróżnia cztery bloki pierwiastków, w których elektrony walencyjne w atomach opisywane są analogicznymi typami orbitali:
|
Blok s: |
• należą do niego pierwiastki grup 1 i 2 oraz wodór i hel. • elektrony walencyjne w atomach tych pierwiastków opisywane są orbitalami typu ns. |
|
Blok p: |
• należą do niego pierwiastki grup 13-18, • elektrony walencyjne w atomach tych pierwiastków opisywane są ortwuUmi typu ns i np. j |
|
Blok d: |
• należą do niego pierwiastki grup 3-12, • elektrony walencyjne w atomach tych pierwiastków opisywane są orbitalami typu ns i (n-l)d,| |
|
Blok f: |
• należą do niego lantanowcc i aktynowce, • elektrony walencyjne w atomach tych pierwiastków opisywane są orbitalami typu ns i (n-Z)f. a czasem także (n-1 )d. |
Prawo okresowości: właściwości pierwiastków uporządkowanych według wzrastającej liczby atomowej zmieniają się okresowo.
Prawu okresowości podlegają
• promienie atomowe,
• elektroujemnośc,
• powinowactwo elektronowe,
• energia jonizacji,
• właściwości chemiczne,
• charakter chemiczny.
Dla pierwiastków bloku s i p zmiany te kształtują się następująco:
|
grupa |
okres |
|
Ze wzrostem liczby atomowej w grupie • promień atomowy rośnie, • elektroujemnośc maleje, • powinowactwo elektronowe maleje. • energia jonizacji maleje, • charakter metabczny rośnie. • aktywność metali rośnie, • aktywność niemetali maleje. |
Ze wzrostem liczby atomowej w okresie • promień atomowy maleje (wyjątek: helowce), • clcktroujcmność rośnie. • powinowactwo elektronowe rośnie, • energia jonizacji rośnie, • charakter metaliczny maleje. • aktywność metali maleje. • aktywność niemetaS rośnie. |
Aktywność metali wiąże się z łatwością oddawania elektronów z powłoki walencyjnej Im dalej od jądra znajdują się elektrony, tym słabiej są przyciągane i łatwiej oddawane
Aktywność niemetali wiąże się z łatwością przyciągania elektronów na ostatnią powłokę Im Miżej jądra jest ostatnia powłoka, tym silniej będą tam przyciągane elektrony.
11
Wyszukiwarka
Podobne podstrony:
DSCN4072 (2) Konfiguracje elektronowe atomów Konfiguracja elektronowa atomu jest to przyporządkowani
ch1 Matura Arkusze chemiiW65911 Zadanie 1. (1 pkt) Przedstaw konfigurację elektronową atomu argonu w
arkusz dI + odpowiedzi0001 ARKUSZ DIZadanie 1. (2 pkt.) Przedstaw konfigurację elektronową atomu, kt
Budow atom (10) Chemia. Fundamenty. Zadania przedmaturalne Zadanie 30. (1 pkt) Zapisz konfigurację e
Egzamin maturalny z chemii Poziom rozszerzony Zadanie 1. (3pkt) Z konfiguracji elektronowej atomu w
chemia�6 Budowa atomu 0 Konfiguracja elektronowa atomu sodu (pełna i skrócona): nNa s22s22p63sl „Na
Zadanie 1. (2 pkt) Pewien pierwiastek X tworzy anion prosty o konfiguracji elektronowej atomu argonu
Zadanie 1. (3 pkt) Z konfiguracji elektronowej atomu w stanie podstawowym pierwiastka X wynika, że w
Zadanie 1. Z konfiguracji elektronowej atomu (w stanie podstawowym) pierwiastka X wynika, że w tym a
Egzamin maturalny z chemii Poziom rozszerzonyZadanie 1. (3 pkt) Z konfiguracji elektronowej atomu w
Ryc. 23.1. Poziomy energii elektronowej: a - atomu. odpowiadające poszczególnym ocbiu-lotn atomowym,
więcej podobnych podstron