39639 str058 (4)

115
Praktyczny szereg napięciowy metali
ĆWICZENIE NR 13
PRAKTYCZNY SZEREG NAPIĘCIOWY METALI
1. NORMALNY SZEREG NAPIĘCIOWY METALI
Wśród pierwiastków metalicznych rozróżnia się metale szlachetne i aktywne (nieszlachetne). Metale szlachetne odznaczają się wielką odpornością na działanie chemiczne, nie ulegają wpływom atmosferycznym czyli działaniu tlenu, wilgoci. Do metali tych należą np. złoto, platyna, srebro, rtęć. W przeciwieństwie do nich metale aktywne ulegają działaniu chemicznemu. Pod wpływem czynników atmosferycznych powlekają sie warstewką tlenków lub wodorotlenków. Często powierzchniowa warstewka tlenku, chemicznie bierna jak w przypadku chromu, aluminium, tytanu z uwagi na dobrą szczelność bardzo skutecznie chroni metal przed dlaszym niszczeniem.
Ilościowo szlachetność metalu można określić wartością potencjału elektrochemicznego powstającego na powierzchni granicznej metalu wobec roztworu jego jonów.
Wartość potencjału elektrochemicznego metalu wyznacza się mierząc silę elektromotoryczną ogniwa zbudowanego z elektrody wodorowej i elektrody z badanego metalu zanurzonej w roztworze własnych jonów. Ponieważ potencjał elektrody wodorowej jest równy zeru, więc wartość siły elektromotorycznej takiego ogniwa odpowiada wartości potencjału elektrochemicznego metalu. (Elektroda wodorowa zbudowana jest z blaszki platynowej pokrytej czernią platynową, zanurzoną w 1 M roztworze HC1 i oplukiwana wodorem pod ciśnieniem 1 atm).
W praktyce zamiast wzorcowej elektrody wodorowej stosuje się wygodniejszą i bezpieczniejsza w użyciu nasyconą elektrodę kalomelową o potencjale +240 mV względem normalnej (standardowej) elektrody wodorowej.
Potencjał elektrochemiczny metalu zależy od stężenia jego jonów w roztworze. Normalny potencjał elektrochemiczny jest to potencjał, który metal przyjmuje wobec 1 M roztworu swych jonów w temperaturze 20°C. Potencjały elektrod zanurzonych w roztworach swych soli można obliczyć ze wzoru Nernsta:
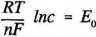
2,303 RT nF
Igc
E0 - potencjał normalny [V];
R - stała gazowa = 8,314 [J mol 'K'1]; T - temperatura [K]; n - liczba ładunku jonu;
F - stała Faraday’a = 96500 [C]; c - stężenie soli [mol/dm3].
Gdy c przybiera wartość mniejszą od jedności, składnik
2,303 RT nF
Igc
staje się ujemny,
co powoduje, że potencjał wraz ze spadkiem stężenia staje się niższy.
Normalny szereg napięciowy metali jest uporządkowanym według kolejności zbiorem potencjałów metali. Dla wybranych metali wygląda on następująco
wzrost szlachetności
|
K/K+ |
Ca/Ca2+ |
Na/Na+ |
A1/A13+ |
Zn/Zn2+ |
Fe/Fe2+ |
|
-2,92V |
-2,87 |
-2,71 |
-1,69V |
-0,76 |
-0,41 |
|
Cd/Cd2+ |
h2/h+ |
Cu/Cu2+ |
Ag/Ag+ |
Hg/Hg2+ |
Pt/Pt2+ |
|
-0,42 |
0,00 |
+0,33 |
+0,79 |
+0,798 |
+ 1,2V |
Wyszukiwarka
Podobne podstrony:
25702 str059 (4) 116 Ćwiczenie nr 132. PRAKTYCZNY SZEREG NAPIĘCIOWY Rys. 1. Ogniwo elektrochemiczne.
Prof. dr hab. inż. Mirosław Żak. Praktykujący rzeczoznawca majątkowy (uprawnienia nr 28). Do 30.09.2
115 Zeszyły Problemowe - Maszyny Elektryczne Nr 2/2013 (99) Marek Klimowski Politechnika Opolska,
DZIENNIK PRAKTYKI ZAWODOWEJTECHNIK USŁUG KOSMETYCZNYCH Nr programu:514[03]/SP/MEN/2000.11.10 Imię i
61272 Slajd5 (115) TRANSMISJA SZEREGOWA- ZASADA DZIAŁANIA typical shift, load, and inhibit seguences
więcej podobnych podstron