CCF20111021�006

lEfflflNarysować wzory elektronowe następujących wodorków: II Br, I Ml, Sili, II..S, IM I
Które z podanych wodorków są lżejsze od powietrza: H2S, NH3, HCI, ( II, Ułożyć równania podanych niżej reakcji:
1) Cl2 + H2 -* ? 3) CaH2 + H20 -> ?
2) S + H2 —> ? 4) N2 + H2 —» ?
EEEE3 Ułożyć równania podanych niżej reakcji lub zaznaczyć, że substancje nic o agują ze sobą:
1) NH3 + H20 -> ? 4) CH4 + H20 -» ?
2) KH + H20 -> ? 5) A1H3 + H20 -> ?
3) HBr + H20 -» ?
Z rurki wypływa gaz, którym jest alboNH3, albo HCI. Jak można je rozróżnił ’
W jakim stosunku molowym należy zmieszać wodór i azot przed syntezą umo aiaku, aby na każdy mol wodoru przypadało 0,5 mola nadmiaru azotu?
Ułożyć równanie chemiczne spalania wodorku wapnia w powietrzu.
12.23.
12.25.
12.26.
12.27.
Wodorotlenki
iB>Jt|'iI Podać wartościowość metalu w wodorotlenkach: Fe(OH)3, Mg(OH)2, Sn(( >11), MaOH.
iWWll Narysować wzory wyjaśniające budowę następujących wodorotlenków: k( >11 :a(OH)2, Mn(OH)3, Zr(OH)4.
iUtłlli Ułożyć równania reakcji chemicznych podanych, zasadowych tlenków mclull :wodą: Li20, BaO, Rb20, SrO.
iitjfsf BI r(')wnanja reakcji chemicznych tlenków podanych metali z wodą: sód,
nagnez, potas, wapń, bar.
iWllVJI Ułożyć równania reakcji podanych tlenków z wodą lub zaznaczyć, że reakiju ue zachodzi: MgO, Si02, Na20, Fe203, CuO.
Ułożyć równania reakcji chemicznych podanych metali z wodą: Li, Ba, La( III)
imcŁfli Ułożyć równania reakcji podanych substancji z wodą lub zaznaczyć, że reakiju ue zachodzi: Mg, Na20, Fe203, K, BaO, Si02.
MMłfl Ułożyć równania reakcji, za pomocą których można dokonać następujących irzemian: Mg —> MgO —> Mg(OH)2.
I_?
O0BH Podać nazwy n«stępujł|cych wodorotlenków: Fe(OH)2, Fe(OH)3, CuOll ( u(()| |)2, Ba(OH)2, Cr(OII)3, Cr(OH)2, KOH, Sn(OH)2, Sn(OH)4.
IMtm Tlenek pewnego jednowartościowego pierwiastka reaguje z wodą, dajq /wiązek, którego wodny roztwór barwi fenoloftaleinę na malinowo. Masa cząsteczkow llenku wynosi 62 u. Podać nazwę i wzór tego tlenku.
I Które z podanych tlenków są tlenkami kwasowymi: S02, BaO, Fe203, C0: k20, P205, N205?
12.38.
| Podać wartościowość reszty kwasowej w następujących kwasach: H2SO3 IIN02, H4P207, H3As04, H3BO3.
12.39.
| Podać wzory tlenków, z których powstają kwasy: siarkowy, węglowy, siarko wy(IV), azotowy, fosforowy.
12.40.
| Co to znaczy, że kwas fosforowy jest kwasem trójhydronowym?
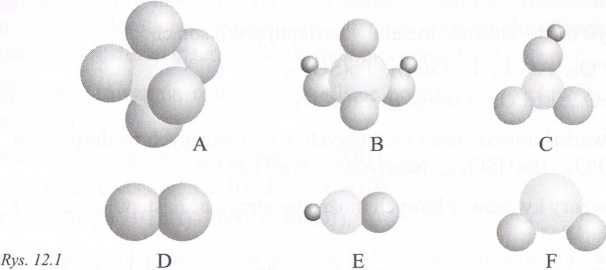
|Na rysunku 12.1 przedstawione są modele przestrzenne cząsteczek: HNO3 11_.S04, SO2, Cl2, PC15 i HCN [cyjanowodór: C(IV), N(III)]. Narysować wzór;
imkturalne tych cząsteczek, a następnie odszukać model każdej z nich.
12.42.
12.43.
[Narysować wzory strukturalne podanych kwasów (w nawiasie zaznaczone wartościowość niemetalu w kwasie):
11) H2S04(VI), HN03(V), H3P04(V), H2S03(IV),
Ii) H2C03(IV), H3As04(V), HC10(I), HN02(III),
C) H4P207(V), HC102(III), H2Si03(IV),
.1) HC103(V), HC104(VII), H4P207(V),
c) HCN [C(IV), N(III)], HSCN [S(1I), C(IV), N(III)].
12.44.
! Dla których z niżej wymienionych kwasów nie można podać wzoru tlenku kwa sowego: H2C03, HN02, HBr, H4P207, HCN, H3BO3?
Wyszukiwarka
Podobne podstrony:
CCF20111021�006 irw<n (Narysować wzory elektronowe następujących wodorków: II Br, l.iH, Sili 11 S
CCF20111022�012 12.21.
CCF20111022�012 12.21.
CCF20111021�005 Rozdział 12. j Związki nieorganiczneiH Tlenki ffli Narysować wzory elektronowe nastę
CCF20111022�010 ( Rozdział 12. Związki nieorganiczneTlenki KOT Narysować wzory elektronowe następuj
CCF20111021�005 Rozdział 12. Związki nieorganiczneEW Tlenki ffli Narysować wzory elektronowe następu
P4060194 Budowa cząstel fio i 1 miw
str (33) H II — S — C = N N2 Cl — Si — H Cl c) OII H — C — O — H BH3 S03 H2Se S. 128. Narysuj wzory
Wzory elektronowe?nzenu i pirydyny H H H H c-C-c-H II 1 II 1 1 • • 1 H Benzene Pyridine HH
28529 P1060304 II. Podstawowe wzory elektromagnetyzmu w układzie SI i w układzie Gaussa Nazwa SI U
TRAD (3) b) tlenku siarki (IV), (lp.) sdstaw wzory elektronowe i określ rodzaj wiązania dla: wodorku
CCF20140322�060 4 9. Podaj produkt reakcji podanego ketonu z następującymi odczynnikami O /II 5
więcej podobnych podstron