img028 (44)

Ćwiczenie nr. 9. Str.4
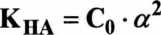

a =
Metody doświadczalne wyznaczania stałych równowag polegają na oznaczeniu stężeń reagentów mieszaniny, w której reakcja chemiczna osiągnęła stan równowagi. Dogodnymi i szybkimi metodami oznaczeń ilościowych są pomiary fizykochemiczne. Równowagę reakcji dysocjacji elektrolitów można badać potencjometrycznie i konduktometrycznie.
Celem ćwiczenia jest oznaczenie stałej dysocjacji słabego kwasu metodą potencjometryczną. Metoda pomiaru polega na potencjometrycznym miareczkowaniu kwasu mocną zasadą. W ogniwie utworzonym z elektrod: szklanej i kalomelowej lub uniwersalnej, mierzy się pH roztworu w czasie miareczkowania. Na podstawie uzyskanych wyników kreśli się tzw. krzywą miareczkowania, z której bezpośrednio odczytuje się logarytm stałej dysocjacji kwasu.
We wzorze opisującym stałą dysocjacji kwasu symdole CH+, CA_ i CHA oznaczają stężenia jonów i cząsteczek niezdysocjowanych po ustaleniu się stanu równowagi. W czasie miareczkowania kwasu zasadą zmniejsza się stężenie zdysocjowanych cząstek kwasu CjjA, a zwiększa stężenie anionów CA-, pochodzących praktycznie z dysocjacji soli.
W momencie zobojętnienia połowy zawartości kwasu w roztworze można przyjąć, że:
Kha Cjj+
PKtIA - -,0gKHA
<-ha = <-a- 1 oraz wykorzystując definicje pH i pK:
pH = -logCII+ otrzymuje się zależność:
pH - pKjjA
Dlatego stopień dysocjacji roztworu słabego kwasu można oznaczyć za pomocą pomiaru pH roztworu, w którym 50% kwasu zostało zneutralizowane zasadą.
2. Część doświadczalna.
Aparatura.
pH-metr sprzężony z układem do miareczkowania potencjometrycznego (mieszadło magnetyczne, biureta, zlewka o poj. lOOcrn3), elektroda uniwersalna.
LABORATORIUM CNEMU FIZYCZNEJ.
Wyszukiwarka
Podobne podstrony:
L.F.B. ĆWICZENIE NR 1 Str. 4 odczytu śrubę mikrometryczną luzujemy i przechodzimy do odczytu na
L.F.B. ĆWICZENIE NR 1 Str. 4 odczytu śrubę mikrometryczną luzujemy i przechodzimy do odczytu na
ćwiczenie nr 7 str.3/3 Pracownia Automatyki Katedry Tworzyw Drzewnych 1. Opóźnione załączenie. Na
L.F.B. ĆWICZENIE NR 1 Str. 4 odczytu śrubę mikrometryczną luzujemy i przechodzimy do odczytu na
L.F.B. ĆWICZENIE NR 1 Str. 4 odczytu śrubę mikrometryczną luzujemy i przechodzimy do odczytu na
img023 (53) Ćwiczenie nr 4_Str.5_ Wyniki ćwiczenia zestawić w tabeli. Drugą taką tabelę sporządzić d
L.F.B. ĆWICZENIE NR 1 Str. 3 temperaturę, aby osiągnąć różnicę temperatur około 10°C. Zalecana
L.F.B. ĆWICZENIE NR 1 Str. 2 Instytut Inżynierii Budowlanej Katedra Podstaw Budownictwa i Fizyki
L.F.B. ĆWICZENIE NR 2 Str. 2 Instytut Inżynierii Budowlanej Katedra Podstaw Budownictwa i Fizyki
więcej podobnych podstron