img023 (53)
Ćwiczenie nr 4_Str.5_
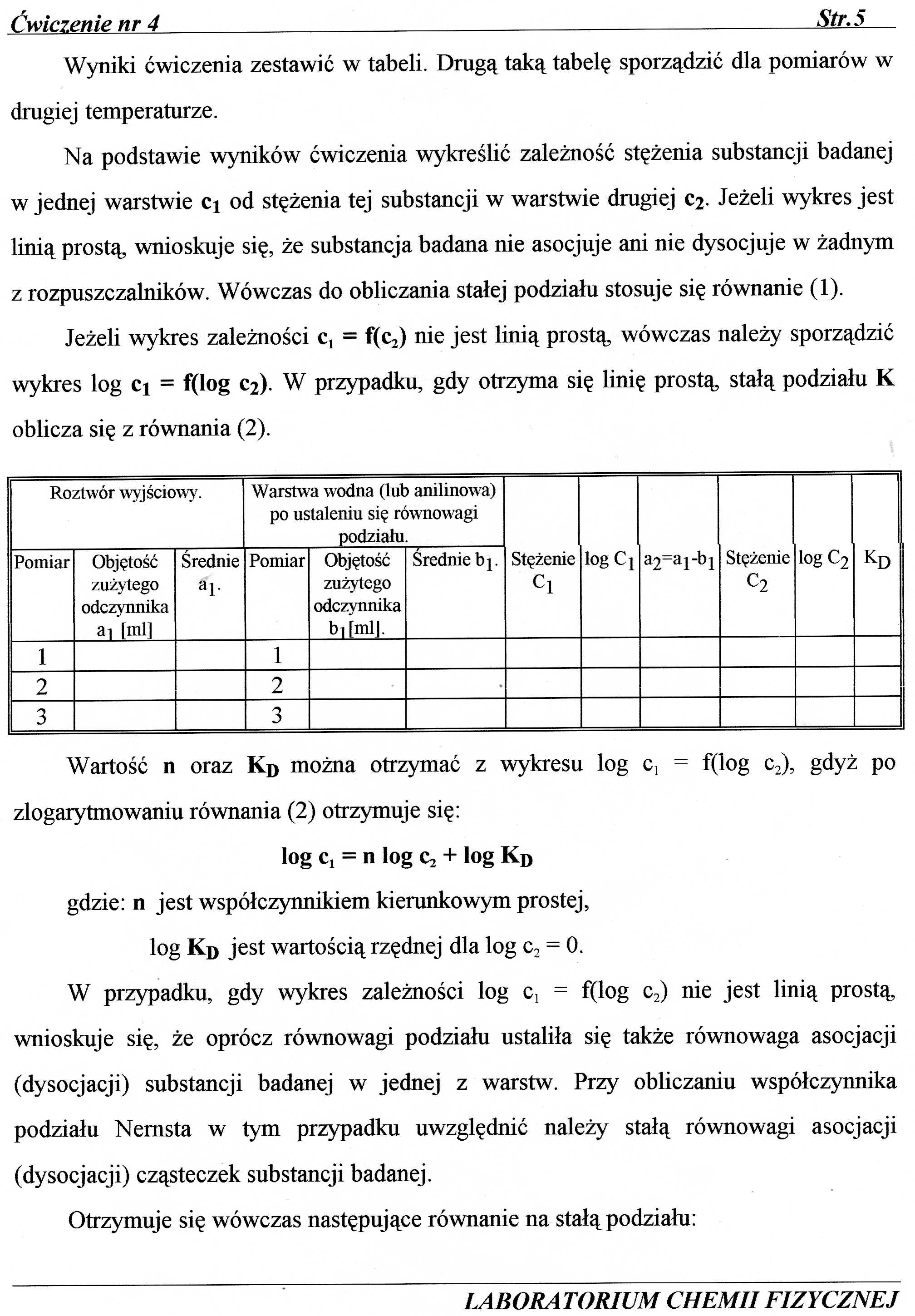
Wyniki ćwiczenia zestawić w tabeli. Drugą taką tabelę sporządzić dla pomiarów w drugiej temperaturze.
Na podstawie wyników ćwiczenia wykreślić zależność stężenia substancji badanej w jednej warstwie ci od stężenia tej substancji w warstwie drugiej C2. Jeżeli wykres jest linią prostą, wnioskuje się, że substancja badana nie asocjuje ani nie dysocjuje w żadnym z rozpuszczalników. Wówczas do obliczania stałej podziału stosuje się równanie (1).
Jeżeli wykres zależności c, = f(c2) nie jest linią prostą, wówczas należy sporządzić wykres log ej = f(log c2). W przypadku, gdy otrzyma się linię prostą, stałą podziału K oblicza się z równania (2).
|
Roztwór wyjściowy. |
Warstwa wodna (lub anilinowa) po ustaleniu się równowagi podziału. |
Stężenie Cl |
logC1 |
a2“a 1 -b 1 |
Stężenie c2 |
logC2 |
KD | ||||
|
Pomiar |
Objętość zużytego odczynnika ai fml| |
Średnie al- |
Pomiar |
Objętość zużytego odczynnika bilmll. |
Średnie bp | ||||||
|
1 |
1 | ||||||||||
|
2 |
2 | ||||||||||
|
3 |
3 | ||||||||||
Wartość n oraz Kd można otrzymać z wykresu log C! = f(log c2), gdyż po zlogarytmowaniu równania (2) otrzymuje się:
log Cj = n log c, + log Kd
gdzie: n jest współczynnikiem kierunkowym prostej, log Kd jest wartością rzędnej dla log c2 = 0.
W przypadku, gdy wykres zależności log Cj = f(log c2) nie jest linią prostą, wnioskuje się, że oprócz równowagi podziału ustaliła się także równowaga asocjacji (dysocjacji) substancji badanej w jednej z warstw. Przy obliczaniu współczynnika podziału Nemsta w tym przypadku uwzględnić należy stałą równowagi asocjacji (dysocjacji) cząsteczek substancji badanej.
Otrzymuje się wówczas następujące równanie na stałą podziału:
LABORA TORIUM CHEMII FIZYCZNEJ
Wyszukiwarka
Podobne podstrony:
L.F.B. ĆWICZENIE NR 2 Str. 6 Otrzymane wartości zestawione w tablicy danych nanosimy na wykres jak p
L.F.B. ĆWICZENIE NR 2 Str. 6 Otrzymane wartości zestawione w tablicy danych nanosimy na wykres jak p
dew0013 26 Wyniki obliczeń zestawić w tabeli 3.3. Tabela 3.3 Wartości średnich sił
50781 SP?331 3. Uzyskane wyniki z doświadczeni* 1-3 zestawić w tabeli i na wykresach. Sporządzić wyk
img028 (44) Ćwiczenie nr. 9. Str.4a = Metody doświadczalne wyznaczania stałych równowag polegają na
L.F.B. ĆWICZENIE NR 1 Str. 3 temperaturę, aby osiągnąć różnicę temperatur około 10°C. Zalecana
L.F.B. ĆWICZENIE NR 1 Str. 4 odczytu śrubę mikrometryczną luzujemy i przechodzimy do odczytu na
więcej podobnych podstron