0000006 2

1) cząsteczka substratu musi łączyć się z enzymem w ściśle określonej orientacji przestrzennej i co najmniej w trzech miejscach zaczepienia, dla uzyskania usztywnionej struktury kompleksu;
2) poszczególne miejsca zaczepienia enzymu muszą być między sobą różne lub asymetryczne;
3) przyłączony związek może mieć tylko dwie grupy identyczne i dwie różne, powiązane z tym samym atomem węgla; połączenie enzymu z substratem zgodnie z podanymi zasadami jest pokazane na rysunku 27.
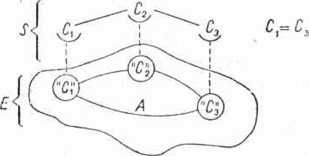
'C\ £ C3
Rys. 27. Schemat przyłączenia suh-stratu do aktywnego centrum enzymu: S — substrat, E — enzym, A — centrum aktywne, C1( C2 i C3 — reaktywne grupy substratu, „Ci”, ,.C2” i „C,” — miejsca kontaktowe enzymu
Mechanizm działania enzymów
Podstawowym elementem katalizy, w tym również enzymatycznej, są: zwiększenie prawdopodobieństwa zderzeń, zmniejszenie bariery energetycznej i ukierunkowanie reagujących cząsteczek. Utworzenie kompleksu enzymu z substratem i ewentualny udział jego w tworzeniu dodatkowych elementów, jak koenzym i inne kofaktory, stwarzają warunki do zaistnienia wymienionych elementów przyspieszających reakcję. Mianowicie ściśle sprecyzowana konformacja centrum aktywnego (str. 90) pozwala na przyłączenie wybiórczo tylko właściwego substratu, względnie substratów, w ściśle określonym położeniu, tzn. właściwym ukierunkowaniu grup reaktywnych. Możliwość wytworzenia kompleksu oraz zmiany układów elektronowych w jego obrębie umożliwiają przebieg zasadniczej reakcji w kilku stadiach, a tym samym rozkład sumarycznej energii aktywacji na mniejsze porcje, co znacznie przyspiesza przebieg całego procesu. Z kolei sztywne ukierunkowanie reaktywnych grup substratu, czy substratów względem siebie, względem koenzymu, czy kofaktora, umożliwia wspomniane zmiany układów elektronowych, co powoduje np. rozkład jednych a wytworzenie innych wiązań. Tego rodzaju rozumowanie jest w zasadzie słuszne dla wszystkich typów reakcji.
Mechanizm katalizy
Zagadnieniem nurtującym uczonych od wielu lat jest wyjaśnienie mechanizmu katalizy enzymatycznej i stworzenie jednego lub kilku ogól-
107
Wyszukiwarka
Podobne podstrony:
PROGNOZA to niepewny sąd BEZWARUNKOWY o kształtowaniu się zjawiska w ściśle określonym momencie w
Przepływy laminarny i turbulentny formują się w dławikach w ściśle określonych warunkach. Jeśli te w
PROGNOZA to niepewny sąd BEZWARUNKOWY o kształtowaniu się zjawiska w ściśle określonym momencie w
18. Nagroda (wyróżnienie) powinna jednoznacznie odnosić się do ściśle określonej
bo romb posiada obie cechy. Podział logiczny musi być dokonany według ściśle określonej zasady, czyl
znacznie dawniejsza. Co ważniejsze, nie musi bynajmniej łączyć się z wyobrażeniem „dzikich”
skanuj0018 (137) • Poruszać się w ściśle określonym szyku, a w szczególności samow
Slajd33 r ^Karp smażony karp smażony tradycyjnie musi znaleźć się na s wiątecznym
img084 2 oksyetylenowania (2:5 cząsteczek tlenku etylenu ) stosuje się do wytwarzania emulsji typu W
więcej podobnych podstron