27347 S0032 (2)
I Suloktywne tworzenie wiązań węgiel węgiel
M. I licrscmann, L. Abraham, Eur. J. Org. Chem., 2002, 1461.
I). Kazmaier, J. Org. Chem., 1994,59, 6667.
)
i •
.łv
M.
JK.
•<)
S j r »
U).
U.
\2,
11. Kazmaier, Liebigs Ann./Recueil, 1997, 285.
A. Krebs, U. Kazmaier, Tetrahedron Lett., 1996,37, 7945.
11. Mues, U. Kazmaier, Synthesis, 2001, 487.
K. Wimalasena, M.P.D. Mahindaratne, J. Org. Chem., 1994,59, 3427.
T.P. Yoon, V.M. Dong, D.W.C. MacMillan, J.Am. Chem. Soc., 1999,121, 9726. T.P. Yoon, D.W.C. MacMillan, J.Am. Chem. Soc., 2001,123, 2911. ll.M. Trost, F.D. Toste, J. Am. Chem. Soc., 1998,120, 815.
K. I liratani, K. Kasuga, M. Goto, H. Uzawa, J. Am. Chem. Soc., 1997,119,12 677. M.E. Jung, T.J. Shaw, J. Org. Chem., 1980,102, 6304.
1.6. Reakcja Hecka
Tworzenie wiązania węgiel-węgiel poprzez arylowanie lub alkenylowanie alkenów pod wpływem katalizatorów palladowych jest powszechnie znane jako reakcja Hecka i z powodzeniem stosowane w syntezie organicznej od ponad trzydziestu lat [1]. Obok Jiro Tsuji, Richard F. Heck jest pionierem tego typu transformacji opierających się na kompleksach palladu.
Pierwotnie reakcja Hecka bazowała na jodku lub bromku arylowym lub winy->wym 1 (jako elektrofilu) i terminalnym alkenie 2 (jako nukleofilu). Początkowo jedyną dogodną metodą tworzenia nowych wiązań węgiel-węgiel, która dawała satysfakcjonujące wydajności produktu 3, była reakcja jodku lub bromku aryln (luli winylu) z terminalnym alkenem zawierającym podstawnik elektronoakcepto-rowy (schemat 1.6.1) [1]. W przypadku nukleofili elektroobojętnych lub zawierających grupy elektronodonorowe duży problem stanowiło tworzenie się regio-izomerów [2, 3],
Ogromną zaletą reakcji Hecka jest możliwość otrzymywania skomplikowanych cząsteczek (często jest to jeden z etapów reakcji domino — patrz podrozdział 7.4) [4], z wieloma grupami funkcyjnymi, także elektronodonorowymi. Mo-
RaX
+
R
Pd°L
n
zasada
R
l
\
R
R
X
1
R =
aryl, winyl I, Br
COOK, CN, Ph itd.
ligami
SHinnat 1.6.1
1.6. R0C1I<< I<J ł Im I n
lii


'«• |csl prowadzenie reakcji w wersji asymetrycznej. Stosując katalizator palla 'tiwy / ehiralnym ligandem, otrzymuje się potężną metodę tworzenia trzecio * • uaiiorzędowych centrów chiralności [3, 5]. W wyniku wewnątrzcząsteczkowcj 1 il • m l leeka można otrzymać związki pochodzenia naturalnego, wielopierśeie-...... 1 i iinkejonalizowane węglowodory aromatyczne i wiele innych.
I 'i akcja prowadzona jest zazwyczaj w środowisku bezwodnym, przy użyciu 1 ul którymi są głównie sole nieorganiczne (często reakcję prowadzi się w za " Mmc). Wymaga długiego ogrzewania w atmosferze gazu obojętnego ze wzglę-i" na podatność ligandów i katalizatorów (a zwłaszcza produktów pośrednich) "a 'li .-aktywujące utlenianie tlenem z powietrza. Jako katalizatory stosuje się za "'"■no proste sole palladu(II), takie jak octany lub chlorki, ich kompleksy ze l 'i“.mu zasadami organicznymi (typu trifenylofosfiny), jak i kompleksy palla i'Mii) < tbecność liganda ma duży wpływ na kinetykę i stereochemię reakcji, a wy 1 ' najhardziej efektywnego jest uzależniony również od typu elektrolila (np.
! i11 i. uantrolina i jej pochodne są efektywnymi ligandami w przypadku arylowa ma i ul łanami, a nie sprawdzają się w przypadku innych elektrofili) [6]. Wiele " kIow tej reakcji omówiono w licznych artykułach przeglądowych, w których ni" na znaleźć również szczegółowe rozważania mechanistyczne [2, 5, 7-111.
[Pd(PPh3)4]
-2PPh3
-HX
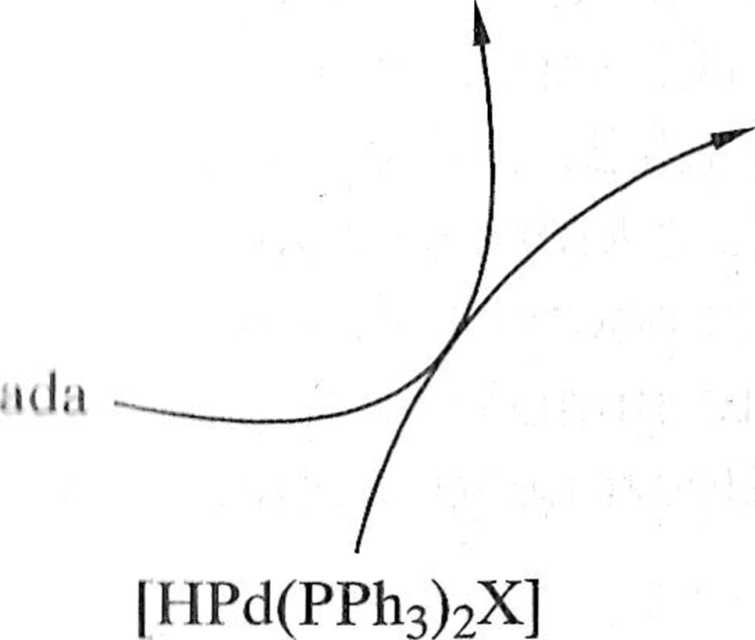
[Pd(PPh3)2]
ł
1

addycja
R X (1)
u1

R
H
I Hi, OSO2CF3
[R1Pd(PPh3)2X]
4

1
R (2)
R


H
St lu imil L(>.2
Wyszukiwarka
Podobne podstrony:
S0032 (2) I Suloktywne tworzenie wiązań węgiel węgiel M. I licrscmann, L. Abraham, Eur. J. Org. Chem
S0032 (2) I Suloktywne tworzenie wiązań węgiel węgiel M. I licrscmann, L. Abraham, Eur. J. Org. Chem
S0041 (2) I. Selektywne tworzenie wiązań węgiel-węgiol u) [Mo] + + ■Ht, tłialkenowy proces
37444 S0030 (2) TMMnlam I Suloklywno tworzenie wiązań węgiel-węgiel Tabela 1.5.1. Synteza estrów all
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
S0027 (2) I Sfilnktywno tworzenie wiązań węgiel węgiel i hiralnego pomocnika związanego kowalencyjni
S0030 (2) TMMnlam I Suloklywno tworzenie wiązań węgiel-węgiel Tabela 1.5.1. Synteza estrów allilowyc
S0036 (2) I Soloktywne tworzenie wiązań węgiel-węgiel talo)-bis[o-(di-otolilofosfino)benzylo]dipalla
S0039 (2) I Se lektywne tworzenie wiązań węgiel-węgiel vvvr*:,n sodu (106 mg, 1 mmol) oraz
S0042 (2) I Selektywne tworzenie wiązań węgiel-węgiel ii) RCM CH CH PhH, 24 h 22 °C wyd. 90% e.e. 95
więcej podobnych podstron