63936 Scan0002 (68)
•iu iriwhflttii dwńt li tinstf;pii|f\i m Ii i * ni * ji
li i! i" unifll i


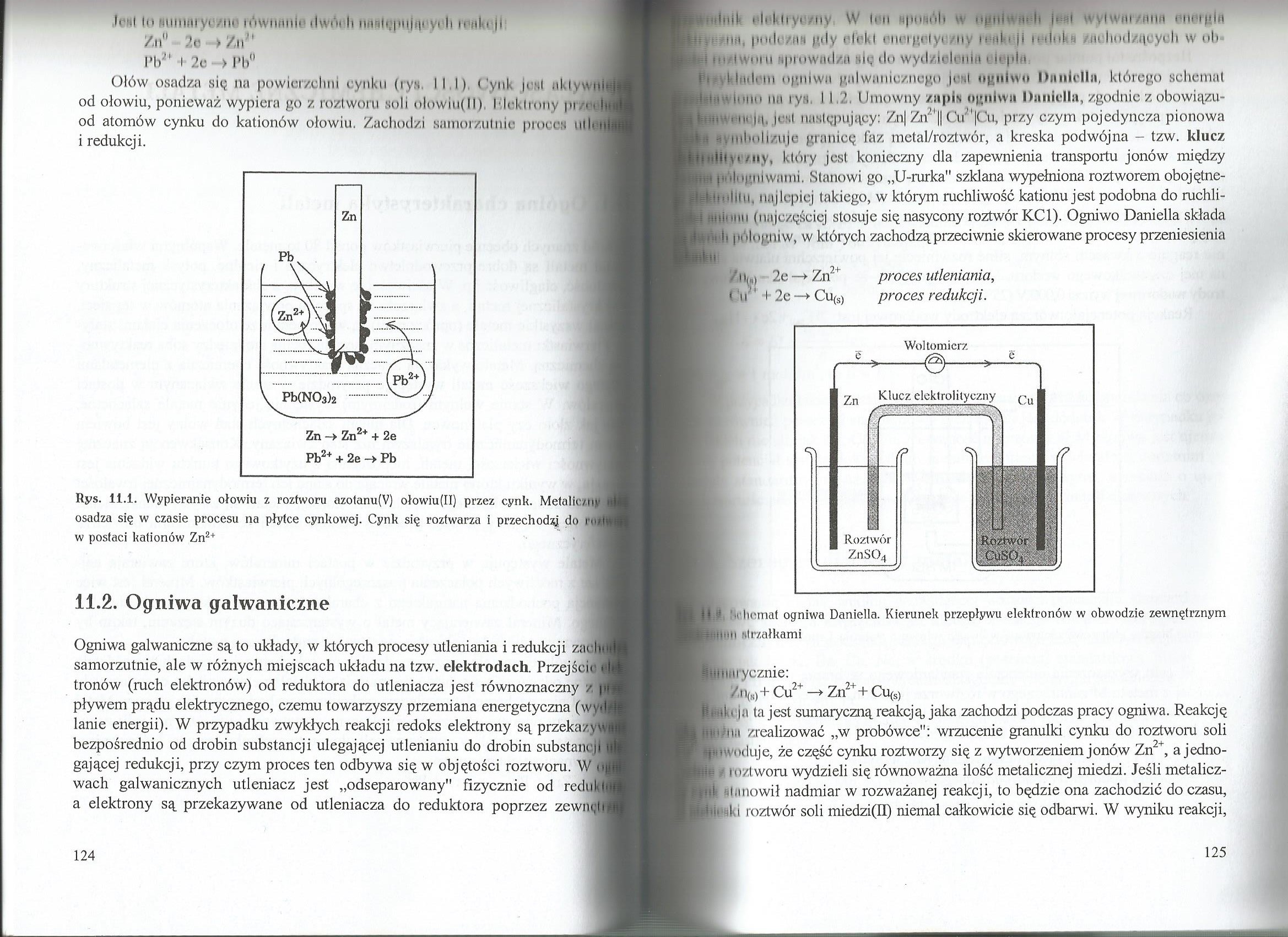
Ołów osadza się na powierzchni cynku (rys III) (ynl. j»-*»l akl. wnb. od ołowiu, ponieważ wypiera go z roztworu soli olowiii(ll) Hckltony pi/* !• od atomów cynku do kationów ołowiu. Zachodzi samorzutnie pioees uli* ni i redukcji.
Zn -> Zn2+ + 2e Pb2+ + 2e Pb
Rys. 11.i. Wypieranie ołowiu z roztworu azotanu(V) ołowiu(II) przez cynk. Metaliczny osadza się w czasie procesu na płytce cynkowej. Cynk się roztwarza i przechodzi do w postaci kationów Zn2+
11.2. Ogniwa galwaniczne
Ogniwa galwaniczne są to układy, w których procesy utleniania i redukcji zarh samorzutnie, ale w różnych miejscach układu na tzw. elektrodach. Przejśch • k-ś tronów (ruch elektronów) od reduktora do utleniacza jest równoznaczny / p-pływem prądu elektrycznego, czemu towarzyszy przemiana energetyczna (wv«! -lanie energii). W przypadku zwykłych reakcji redoks elektrony są przekazy" bezpośrednio od drobin substancji ulegającej utlenianiu do drobin substancji i gającej redukcji, przy czym proces ten odbywa się w objętości roztworu. W 0(H wach galwanicznych utleniacz jest „odseparowany" fizycznie od redlili' a elektrony są przekazywane od utleniacza do reduktora poprzez zewiu;li
huk • I* I-11 \ i nv W )• u ppnsób »* i* i i I - a-- !> Mt - . to m nna t In ifHn
'■fi, 1111111 ;i]3 gily rlrkt t mi gul \ l 11. H;?d - |l i • d- 1 =n hud rgryt !l W uli : "• łv "III Hjll • iWitcI/H ul i; «l" Wyil lt’l' ilifi 1 i1 j»(i!
I ludi ni ogniwa galwanicznego jud ogniwo imnlellii, l dótego schemat i"ii" n.i ryg. I I 2 Umowny zapis ogniwu Daniella, zgodnie z obowiązu-i" i t a .1 iuislt;i)iij;\oy: Zn| Zn2'|| Cu 1 |Cu, przy czym pojedyncza pionowa 'iilinli/.njc granicę faz metal/roztwór, a kreska podwójna - tzw. klucz iiiM/iiy, Idóry jest konieczny dla zapewnienia transportu jonów między . >!"!'iiiwiinii. Stanowi go „U-rurka" szklana wypełniona roztworem obojętne-iliii, najlepiej takiego, w którym ruchliwość kationu jest podobna do ruchli-iiu (najczęściej stosuje się nasycony roztwór KC1). Ogniwo Daniella składa 11 ("ilnjuiiw, w których zachodzą przeciwnie skierowane procesy przeniesienia
ąiliit!
r t t/S) 2e —> Zn2' proces utleniania,
Un'' i 2e —> Cu(S) proces redukcji.
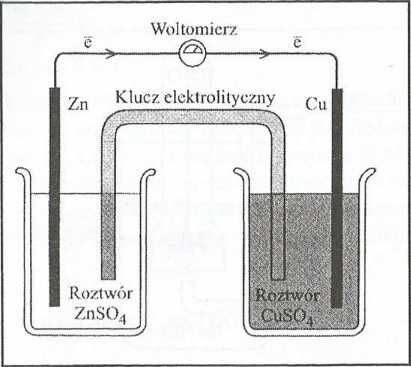
'■1 ; .i liemat ogniwa Daniella. Kierunek przepływu elektronów w obwodzie zewnętrznym ■ ■ "*i nlrzałkami
■'Hiiycznie:
/ri(K)+ Cu2+ —> Zn21 + Cu(s)
«kuj a ta jest sumaryczną reakcją, jaka zachodzi podczas pracy ogniwa. Reakcję na zrealizować „w probówce": wrzucenie granulki cynku do roztworu soli • - oduje, że część cynku roztworzy się z wytworzeniem jonów Zn2", ajedno-i"/tworu wydzieli się równoważna ilość metalicznej miedzi. Jeśli metalicz-1 stanowił nadmiar w rozważanej reakcji, to będzie ona zachodzić do czasu, I i roztwór soli miedzi(II) niemal całkowicie się odbarwi. W wyniku reakcji,
125
Wyszukiwarka
Podobne podstrony:
Scan0002 (68) •iu iriwhflttii dwńt li tinstf;pii
Scan0005 (57) Zn0 + Cu2+ -> Zn2+ + Cu0 Miedź osadza się na powierzchni cynku (najczęściej postaci
21243 scan0005 (68) finansowych po stronie pasywów i odpowiadającego im zastosowania (odzwierciedlon
save0008 (22) 1/ rtjdtĄL ^dtdc:rVurcot^j 2 q_ *OCLh/huÓl/cLwxAHr iawc(Iu^ća*£d Ą li A l 4/ H-J PO«j
Scan0002a % r/fc/ Pc jl i i _i__J i i i t i 1 I j_ _ —V— » v li . •— ^ 1
Scan0008 tmŁwO fOdiwjLoic^. . { fOdjyy&Hobrt. O S^Li- pOM>Q
więcej podobnych podstron