65036 IMGX03 (3)

5 Na rysunku 5.8 przedstawiono diagram korelacyjny dwuatomowej molekuł) o jednakowych jądrach. W diagramie odległość międzyjądrowa r rośnie od zera do nieskończoności (od lewej strony ku prawej), przy czym skala na osi odciętych zagęszcza się z prawej strony. Odpowiada to faktowi, że w miarę wzrostu r energia zmienia się w sposób nieliniowy, a odpowiednie poziomy możemy wtedy łączyć liniami prostymi. Dla odległości r odpowiadających konkretnym molekułom możemy na podstawie diagramu korelacyjnego określić kolejność orbitali molekularnych, zidentyfikować termy elektronowe i przypisać im odpowiednie funkcje falowe.
Jeżeli rozkład ładunku jąder w molekule ma środek symetrii, to termy elektronowe mogą być albo parzyste (g)f albo nieparzyste («), co znaczy, żc albo ich funkcje falowe przy operacji odbicia w środku symetrii nie zmieniają znaku (</), albo zmieniają znak (u). Taki podział występuje m.in. w molekule dwuatomowej o jednakowo naładowanych jądrach.
Z diagramu korelacyjnego nie można odczytać dokładnych różnic poziomów energetycznych danej molekuły, ale diagram umożliwia przypisanie pasmom w zarejestrowanym widmie termów elektronowych, między którymi następuje przejście spektralne. Wskazuje też, które stany elektronowe są trwałe, a które nietrwałe. Jeżeli w miarę zbliżania się atomów (na rys. 5.8 z prawej strony ku lewej) następuje obniżanie energii, to oznacza to przyciąganie się atomów i tworzenie trwałego wiązania — orbita! jest wiążący. Jeżeli natomiast przy zbliżaniu się atomów energia ulega podwyższeniu, to atomy się odpychają, wiązanie nie powstaje, a orbita! jest j antywiążący.
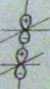
|
du2p | |
|
°r" * 7^- |
*o2p |
|
xu 2p | |
|
OęZp | |
|
du2s • |
0o2s
2p
2p
2s
2s

0a1S

dwa nieznacznie oddziaływające no siebie atomy
dwa rozdzielone olany
Ryg. 5.9. Kształty orbitali i układ ich poziomów energetycznych w dwuatomowej molekule o jednakowy* ładunkach jąder (według G.M. Barrow. „Introduction to Molccuiar Spectroacopy”, New York 1961 rys 10-15b, s. 255; za zgodą Wydawnictwu McGraw-HiU Book Company ©)
Rozpatrzmy dokładniej prawi) część diagramu korelacyjnego przedslawioni) na 6.2 rysJ 5.9. Widzimy, że orbitale a i n. są wiążące, a orbitale it. i nt są antywiążące, Kształt orbitali tłumaczy również, parzystość y lub nieparzystość u łermów elektronowych. W tym przypadku rozważamy zmianę znaku funkcji falowej przy odbiciu w środku symetrii molekuły.
W diagramach korelacyjnych molekuł o niesymetrycznym rozkładzie ładunków jąder ze względu na brak środka symetrii nie rozróżniamy termów y i u. Każdy oddzielny atom wnosi swoje poziomy do diagramu korelacyjnego. Przykład diagramu dla dwuatomowej molekuły o różnych ładunkach jąder przedstawiono na rys. 5.10.
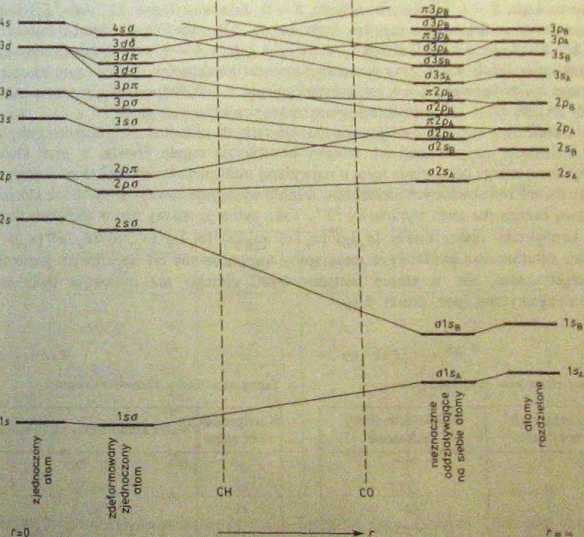
Rys. 5.10. Układ orbitali dwuatomowej molekuły AB o różnych ładunkach jąder. Zaznaczono układ orbitali molekuł CH i CO (według G. Hcrzberg, „Molccuiar Spectra and Molccuiar Strueture. I. Spectra of Diatomit Molecules”; za zgodą Wydawnictwa Van Nostrand Reinhold Company, New Jersey 1950, rys. 156, fi 328)
2 atomowych orbitali s, p, d powstają orbitale molekularne <r, n, S. Przy wypełnianiu kolejnych orbitali elektronami obowiązuje w molekule, podobnie jak w atomie, zakaz Pauliego. W molekule nie może być elektronów o jednakowych wszystkich liczbach kwantowych. Przynajmniej jedna z liczb kwantowych musi
Wyszukiwarka
Podobne podstrony:
7 (181) Zadanie 16. Na rysunku przedstawiono krokowy diagram stanów dwóch siłowników pneumatycznych
Fizyka 2, termin I, zestaw A,# 06 2010 cz 2 Egzamin z fizyki II - termin I, zestaw B 23.06.2010 7. N
Image091 Charakterystyki wyjściowe bramek VQ = f(lQ) Na rysunku 4.7 przedstawiono charakterystyki UO
Zadanie 1. Na rysunku przedstawiono sieć o topologii A. siatki. B.
skrypt034 34 azotowego i azotawego, które powodują korozję ich powierzchni. Na rysunku 2.5 przedstaw
Slajd14 (121) Charakterystyki tranzystora potowego Na rysunku a) przedstawiona jest c h arak te ry s
więcej podobnych podstron