S0030 (2)
TMMn
I Suloklywno tworzenie wiązań węgiel-węgiel
Tabela 1.5.1. Synteza estrów allilowych N-trifluoroacetyloglicyny (3) (schemat 1.5.7)
|
J . . i - ■ :!:..a- =’ V j. «fI Alkohol : ;.': JH.jl _________L |
Wydajność [%] |
Temp. top. [°C] |
|
97 |
39-40 | |
|
98 |
48-49 | |
|
94 |
1 81-82 |
Tabela 1.5.2. Przegrupowanie Claisena estrów allilowych N-trifluoroacetyloglicyny (3)
(schemat 1.5.7)
TfaHN
Substrat

i??. :
.
:: ?
: <
J i - .I:’: - '•
_
O
TfaHN
Produkt3
n
Wydaj
1 - [%]
■
: ; r/rs
i
-—
hi
e,e.c[%]
■ •;; li ; ' ; :
_L_
98(41)
Hi
v'
li
■ '

Md
(CHCl3)d

77
(>99)
94,5-95
+36,2

© ©
COO PEA

TfaHN

O

TfaHN

© ©
COO PEAU
96(74)
87
(>99)
128
+38,2
TfaHN
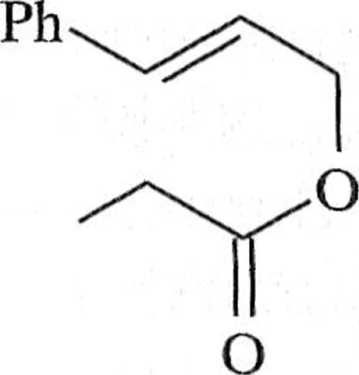

TfaHN

© © COCTYEAr
92(45)
66
(>99)
132-133,5
+50,5
Tfa = CF3C()
l+odukl i» iikc|i ptnmowanej chinidyną. h Wydajność surowego aminokwasu; w nawiasie podana wydajność krystalizacji / IM (A Nn»liimu rnanejomeiyezny surowego produktu (estru metylowego); w nawia.u nadmiar enan e|omciy< zny po l« 1 vul -ill,■u |t .* p| a 11 )nne dla soli (,V) aminokwasu z (/v*) IM ;,A.
i
1 ii i
N
l' "1"i;mic (4 ml), oziębić do -78°C, po czym dodać powoli świeżo przyrządzony |‘ • w«»r U IMDS (1). Mieszaninę reakcyjną doprowadza się do temperatury po "l"Wej w ciągu 12 godzin, przy mieszaniu magnetycznym w atmosferze gazu Mylnego. Następnie dodaje się eteru dietylowego (50 ml) i 1-molowego ‘■'IM >, (25 ml) i miesza przez godzinę. Po rozdzieleniu warstwę organiczną ' ' mywii się jeszcze raz 1-molowym NaHS04 i produkt ekstrahuje się nasyco-" 111 loztworem NaHC03 (3 • 25 ml). Warstwę wodną zakwasza się poprzez doda-" ""<■ stopniowo stałego NaHS04 do pH 1, po czym produkt ekstrahuje się eterem
I *' h lowym (3 • 25 ml). Warstwę organiczną suszy się nad Na2S04 i odparowuje
puszezalnik. Do roztworu surowego produktu o stężeniu 0,1 mol/1 (eter diety ) dodaje się dokładnie jeden równoważnik odpowiedniego enancjomem
II \ (2). Całość pozostawia się na noc w zamrażalniku, po czym odsącza się '11-trony produkt. Szczegóły patrz tabela 1.5.2.
Przegrupowanie kwasu 5,6-0-izopropylideno-2-0-E--krotylo-3-O-metylo-L-askorbinowego (4) (schemat 1.5.8) [27]
1 r- \6-0-izopropylideno-2-<9-.E-krotylo-3-0-metylo-L-askorbinowy (4) (568 mg, mmol) (3) rozpuszcza się w 5 ml toluenu i całość ogrzewa pod chłodnicą 11ilną przez cztery godziny, otrzymując mieszaninę produktów 5 i 6 w stosunku 1 I1' (4). Diastereoizomery można rozdzielić chromatograficznie.




1.1). Przegrupowaniu |.ł,J| .itimuhopowo
Przegrupowanie Claisena katalizowane chlorkiem glinu
(schemat 1.5.9) [28]
i '-i l olby zawierającej bezwodny chlorek glinu(III) (13 mg, 0,1 mmol) (5) należy powadzić roztwór (Cj-AZ-krotylomorfoliny (142 mg, 1 mmol) w 4 ml bezwodne m 11U >i ku metylenu. Następnie wprowadza się i-Pr2NEt (0,26 ml, 1,5 mmol) i ca i • ■ miesza się przez pięć minut. Następnie dodaje się 1-molowego roztworu i-h u ku propionylu (1,46 ml, 1,21 mmol) w chlorku metylenu. Całość miesza się i .sześć godzin i po tym czasie dodaje się 30 ml eteru dietylowego. Rozdwoi i i - mywa się 1-molowym NaOH (10 ml), solanką i warstwy wodne dodatkowo i iialmje się 40 ml eteru. Połączone ekstrakty suszy się nad Na2S04 i odparoww i- i o/puszezalnik. Otrzymany surowy produkt oczyszcza się poprzez chromało . ilię kolumnową, stosując jako eluent eter dietylowy. Produkt ma postać oleju, wydajność wynosi 131 mg (92%).
Asymetryczne O- i C-alkilowanie fenolu (schemat 1.5.11) [30] o (24'yklohekseiiylo) 1,5 mctyWundioksyfcnol (9): Do roztworu 8 (261 mg,
In/ mmol) w 3 ml odgn->iw iim go tliloiku metylenu dodaje się (I A\3/\’)
Wyszukiwarka
Podobne podstrony:
37444 S0030 (2) TMMnlam I Suloklywno tworzenie wiązań węgiel-węgiel Tabela 1.5.1. Synteza estrów all
S0030 (2) TMMnlam I Suloklywno tworzenie wiązań węgiel-węgiel Tabela 1.5.1. Synteza estrów allilowyc
S0041 (2) I. Selektywne tworzenie wiązań węgiel-węgiol u) [Mo] + + ■Ht, tłialkenowy proces
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
S0027 (2) I Sfilnktywno tworzenie wiązań węgiel węgiel i hiralnego pomocnika związanego kowalencyjni
S0032 (2) I Suloktywne tworzenie wiązań węgiel węgiel M. I licrscmann, L. Abraham, Eur. J. Org. Chem
S0036 (2) I Soloktywne tworzenie wiązań węgiel-węgiel talo)-bis[o-(di-otolilofosfino)benzylo]dipalla
S0039 (2) I Se lektywne tworzenie wiązań węgiel-węgiel vvvr*:,n sodu (106 mg, 1 mmol) oraz
S0042 (2) I Selektywne tworzenie wiązań węgiel-węgiel ii) RCM CH CH PhH, 24 h 22 °C wyd. 90% e.e. 95
S0046 (2) I Selektywne tworzenie wiązań węgiel węgio! jącego 2-3 mg BHT. Roztwór ten wkrapla się prz
więcej podobnych podstron