skanuj0011 (2) bmp

(Śmie i nazwisko)
CA ,
Powierzchnią właściwą można obliczyć wykorzystując równanie; A. Henry'ego, p>
Langmuira.
BET,
Langmuira lub BET.
Funkcjami stanu są;
!(M energia wewnętrzna, entalpia, entropia, entalpia swobodna, u. ciepło, entalpia, entropia,
C. ciepło, praca, energia wewnętrzna.
. D. encrg'2 wewnętrzna. entalpia, praca objętościowa. ______-
D!a4 mola gazu doskonałego różnica Cf—C. jest równa:
R, --/
C. nRJ,
D. 1°.
Mieszaniny eutekiyczne doskonale wysiąppjąw przypadku:
A całkowitej nicmicszaicośd składników w stanic ciekłym i __ stałym,
i®/ całkowitej niemicszalnciśd składników w stanic stałym,
C całkowitej mieszainości składników w stanie ciekłym,
D. całkowitej mieszainości składników w stanie stałym.
Kiedy układ zwiększa swoja objętość, praca objętościowa jest równa:
C.
L\ /U"
Teroperarurową zależność entalpii opisuic równanie i Drawo;
A.
B. Gfbbsa,
(Ti Kirchoffa,
D. Clacsiusa.
-lO-żar-T* e eKscakcii stanowi:
B.
C
©
13.
14.
15.
16.
•-
Większą wydajność ekstrakcji możn2 uzyskać:
A. prowadzące ekstrakcję jeden raz z użyciem całej om i
rozpuszcza!nuta,
- Bj prowadząc eksuakcję wielokrotnie z użyciem marvc- -or^-': rozpuszczalnika,
C prowadząc ekstrakcję wielokrotnie pod zmniejszcnvm ciśnieniem,
D. odpowiedzi B i C są prawidłowe.
Wskaż nieprawdziwe zdanie:
.„ (Aj trójkąt Gibbsa jest trójkątem, w którym wierzchołki reprezentują 0% czystych składników,
B. trójkąt Gibbsa jest trójkątem, w którym wierzchołki reprezentują 100% czystych składników,
C trójkąt Gibbsa jest trójkątem równobocznym, w kier-— bok AC reprezentuje skład procentowy mieszaniny dwuskładnikowej A i C
D. trójkąt Gibbsa jest trójkątem równobocznym, w kić-— cole wewnątrz "boków reprezentuje skład mieszaniny trójskładnikowej.
Górna krytyczna temperatura mieszania (rozpuszczania) jer.
temperatura
A poniżej której występuje pchra mieszalność obu ciecz/.
@ powyżej której ciecze mieszają sic w dowolnych stosunkach,
C. po przekroczeniu której następuje rozdział na dwie :ar-
D. teraperamra powyżej której nic rr.GŻna skroplić g*z.
Z roztworem azeotropowym dodatnim mamy do -eryniez:.
oddziaływania pomiędzy składnikami A i B roztworu są.
|
A |
A |
A = B B | |
|
B. |
A |
A - B —* 3 | |
|
C. |
A |
<-*■ B > A -*-*■ A. B *-*■ |
O LS |
|
A |
■■o* B < A-* A. 5 — |
B |
prawo i zemsta, prawo Henry'ego,
C prawo Raouita.
O. rcguŚ2 faz Gibbsa.
Wielkość pojemności cieplnych C, i C,:
A. zależy cd temperatur-' i ciśnienia.
B. nie zależy cd temperatury.
C. maleje wraz ze wzrostem temperatury,
-JD.; rośnie wraz ze wzrostem temperatury.
Zmiana entropii dla przemiany fazowej jest równa-\A óHfT,
B AHT,
C. Al'-7,
D. 7AS.
Cząstkowa objętość molowa składnika i w mieszaninie jest rów na:
A. objętości molowej cz-Siego ).-.;:a*:ra.
B. średniej objętości molowej czystych składników,
C. 22.^ dm3,
^ *Vi A/!- ,f£y-
Temperaturs krytyczna cieczy jest:
A. równa temperaturze wrzenia,
(By wyższa od temperatury wrzenia.
C. niższa od temperatury wrzenia,
D wyższa lub niższa od temperatury wrzenia w zależności od ciśnienia.
Wspćiczymnik podziału substancji trzeciej pomiędzy dwie fazy
, c,
X = — mcjcst stały';
C.
A. w stałej temperaturze.
E. edv dwie fazy się nic mieszają,
C. opy substancja trzecia występuje w- obu fazach w tym samym stanie cząstccz-Łcwym,
r ?dv substancja trzecia zmienia swój stan cząsteczkowy w jednej bądź obu fazach (asóćjaga, dysocjzeja).--'
tJTłcram fenowy ciccz-p*rj dla układu dwuskladnilorwc^o A ~ 8
pod ciśnieniem p- 1 atm. wygląda następująco;
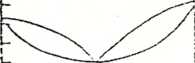
Podczas destylacji roztwofl* A - 3 o stęża?.iu xĄ - 0T7otrzymajmy
A. obydwa czyste składniki A i B.
B. tylko czysty składnik A,
......-/O nic otrzymamy żadnego czystego składnika.
U. tylko czysty składnik B.
18. Wybierz reakcję, dla której warunkach normalnych iu A// są, takie same;
19.
Q Ag'
W przypadku układu dwuskładnikowego, rworząccego liczba stopni swobody wy nosi;
A. 1,
0 2.
C. 3.
D. 0.
(><0
Cl
c0 t ASj^g > 0 . n to
Dla pewnej rcakdi A/r^
srwierdzeń jest prawdziwe w odmcsjcr.rz do reakcji w 298 K:
ire z pcłuzszyeib
i ej równowag. ::
K
i rośnie wrze — wzrostem temperatur
2U > 1 i maleje wraz ze wzrostem temperatury.
ostem tempera rury.
< ^ 1 rośnie wraz cc w
■^2?i 1 i tnalcje wraz ze wzrostem temperatury'.
"T"7
f~S~\ s-\\
.j)
sN
11.
Wyszukiwarka
Podobne podstrony:
skanuj0019 bmp () IV. Opracowywanie potrzebnych materiałów ( zasem nazwisko jedynego autora umieszcz
skanuj0028 Gd U fi M i Jz I TtzgNł C? AZF
skanuj0041 (43) r 100-2000 Nazwisko i imię
skanuj0010 (70) 4.4.fi REGIONALNE LABORATORIUM BUDOWNICTWA PRZY KKBiTB PG - ZAKŁAD KONSTRUKCJI
skanuj0028 Gd U fi M i Jz I TtzgNł C? AZF
skanuj0037 " p. ^5 „ fi i n 0 »■ >4= iffffrjfiM rg P.fc* tI itiM 1 STłf T
skanuj0041 (43) r 100-2000 Nazwisko i imię
SNC00061 Sprawdzian X / J • i I fi) 4 * ^ b. Zostaw I. Nazw
więcej podobnych podstron