3582327069
|
Data: 13.05.2009r. |
Środa 12.: |
.5-16.00 |
|
1. Magdalena Parzych 2. Rafał Buga |
Ocena z przygotowania: |
Ocena ze sprawozdania: |
|
Prowadzący: Mgr inż. Maciej Zawadzki |
Podpis prowadzącego: | |
Badanie kinetyki reakcji inwersji sacharozy
1. Cel ćwiczenia
Celem ćwiczenia jest zbadanie kinetyki reakcji inwersji sacharozy, wyznaczenie stałej szybkości reakcji w rożnych temperaturach oraz wyznaczenie energii aktywacji
2. Opis metody
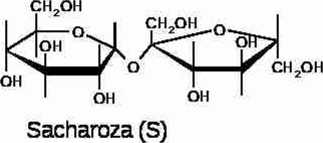
Inwersja sacharozy zachodzi zgodnie z równaniem;
+
+
H
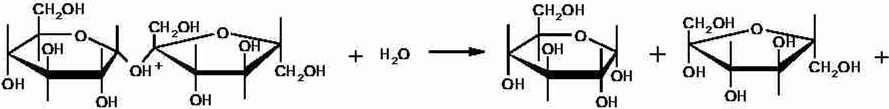
+
H
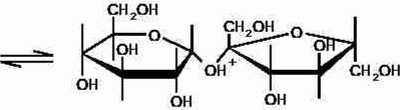
S+HU- >SH* (1)
Sacharoza w formie sprofanowanej (Sl-f) Glukoza (G) Fruktoza (F)
co można ująć schematycznie: ,
SH*+H20—&->G+F+H* (2)
Pierwszy etap przebiega szybko, zaś drugi jest procesem powolnym. On to właśnie decyduje o szybkości reakcji.
Stałą szybkości reakcji wyznaczymy metodą Guggenheima. Po wykonaniu pomiarów w danej temperaturze szacujemy wielkość A. Jest to czas, w którym reakcja przebiegła co najmniej połowicznie. Stalą szybkości wyznaczamy wykorzystując zależność: ln{or(t) — cc(t+A)} = —kt +const., gdzie pomiary a i OL' wykonane są w odstępie czasu A, zaś a={3cl, gdzie „c" jest stężeniem roztworu, „1" długością drogi światła w roztworze substancji optycznie czynnej, zaś {3 skręcalnością właściwą danej substancji. W celu wyznaczenia stężenia substancji optycznie czynnej korzysta się z zależności stężenia i kąta skręcenia substancji optycznie czynnej.
Roztwory związków optycznie czynnych (np. sacharoza, fruktoza, glukoza) posiadają właściwości skręcania płaszczyzny polaryzacji światła. Zmiany stężeń reagentów można śledzić obserwując skręcalność optyczną roztworu w czasie. Wykorzystuje się przy tym fakt, że sacharoza jest optycznie prawoskrętna powstająca glukoza również, natomiast fruktoza w
1
Wyszukiwarka
Podobne podstrony:
li 8:00 Poniedziałek 10-05-2021 Wtorek 11-05-2021 Środa 12-05-2021 9:00 Logistyka dystrybucji,
Sytuacja Epidemiczna na terenie gmin Powiatu Pilskiego Stan na dzień 13.05.2020 r. Godz. 12:00
skanuj0009 (168) Data: 13-05-2010 Obiekt Temat6 OBLICZENIE PUNKTÓW POMIERZONYCH METODĄ DOMIARÓW Punk
Noc Nauki 17.00-21.00 (wszyscy zainteresowani) KAMPUS POLITECHNICZNY ul. Dmochowskiego 12 16.00
ki 31 stycznia (środa) godz. 16:00 2 luty (piątek) godz. 16:00 i} 7 luty (środa) 9 luty (piątek)
16.11.2016 (środa) godz. 16 00 - 17 00 Zajęcia dla dzieci z zaburzeniami mowy pt. „ Chcę mówić
DEBATA ON-LINE Dokqd zmierza współczesne dziennikarstwo? 27.01.2021 r. (środa) godz. 16:00
8:00-9:30
rejestry scalone instrukcja (3) •*-5V 16 PS_B 1 VCC LED3 LED1 LEq 2 LEDO 12 13 14 ii 03 02 01
12.00 12.10 12.30 12.45 13- 05 13.25 13.45 14- 05 14.25 14- 55 15-
8:00 9:00 10:00 11:00 12:00 13:00 14:00 15:00 16:00 17:00 18:00 19:00 20:00 Piątek
8:00 9:00 10:00 11:00 12:00 13:00 14:00 15:00 16:00 17:00 18:00 19:00 Poniedziałek
7:00 8:00 9:00 10:00 11:00 12:00 13:00 14:00 15:00 16:00 16:00 -
Den 8:00-9:00 9:00-10:00 10:00-11:00 11:00-12:00 12:00-13:00 13:00-14:00 14:00-15:00 15:00-16:00
ŚRODA 8.00- 12.00 4 kawy, 2 kawałki panierowanego łupacza (gotowego) z 25 g masła 16.00
e-mail: aga-cm(5)amu.edu.pl środa 12:00-13:00 pok. 206 (bud. D) Prof. UAM dr hab. Andrzej Ćwikliński
więcej podobnych podstron