3582334285
Lekcja 3 Rys. 2
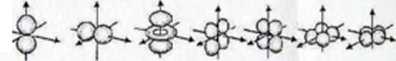
] kwant energii n - 1
O
2 kwanty energii n = 2
3 kwanty energii
n-3_
4 kwanty energii _n ■ 4_
5 kwantów energii _n-=-S_
[
6 kwantów energii n "6
O Ą-Ą+Ąu
O -5^
0-S5Ł-

n,V -*J'y SjK sl^ sy/ n|/ sJ/ s-i7 •wi/ nX/ sJ^ nJ^ "sr* nK v|:/ nI7
✓p* yp* ✓p* ✓p* ?p* ?p* yp* y|^ yj*'* yp* yp* yT^ yf-* yj "* yT^ yT^
7 kwantów energii n * 7

Lekcja 3
>c pk >c >c >c >c >c >c >c >c >c >c >c >c ><. >c >c >c
>c >c >c >c >c >c Y- ste >k
Wśróć brył wynikających z rozwiązania równania Schroedir.gcra niektóre charakteryzują sic tym, że elektrony, kióreje obsadzają mają identyczną liczbę kwantów energii. Zespól takich bryj nazywamy powloką Liczbę kwantów energii określa gfówn3 liczba kwantowa .,ń”. Liczba powłok nie jest niczym ograniczona jednak atomy w stanie podstawowym (o możliwie najmniejszej energii) nigdy i.ie ubsacizają do winki wyższej niż siódma. Współrzędne bez wrysowanych- brył oznaczają te funkcje, która można -wyznaczyć matematycznie, ale których atomy nie oosadząją.
Wyszukiwarka
Podobne podstrony:
180 03 2 Rys, 3,2. Strumienie energii krzyżujące się na stoie.
Rys. 1.1. Produkcja energii pierwotnej (w Mtoe) w Polsce z biomasy stałej w latach 2003 - 2012 (opr.
Scan Pic0090 Przeskakując z orbity pierwszej na trzecią elektron pochłania kwant energii o wartości
0010 2 Kwant energii ma więc masę m — Av c2 1.3 jeżeli masę, to i pęd — (X — długość
025 5 V m h A (2.5) fil/tf A • ^ n/nar/a dtagnśl fali promieniem ania Okazuje się. Ze kwant energii
Rys. 3. Średnia energia wiązania nukleonów w trwałych jądrach atomowych w funkcji liczby masowej A.
rys2 4 Rys. 2.4. Zależność energii od liczby falowej dla swobodnych elektronów (linia ciągła)
rys5 9 Rys. 5.9. Zależność energii swobodnej faz n i
więcej podobnych podstron