3544
Cząstki powietrza w temperaturze 273 K i pod ciśnieniem 1 atm. d = 210'8 cm, v = 105 cm/s, n = 3-10,9/cm3.
Wówczas średnia droga swobodna jest równa 2-10'5 cm (około lOOOd).
Odpowiednia częstość zderzeń wynosi 5109/s.
17.2 Rozkład prędkości Maxwella
Na poprzednim wykładzie omawialiśmy prędkość średnią kwadratową cząsteczek gazu. Jednak każdy gaz ma charakterystyczny rozkład prędkości, który zależy od temperatury (cząstki nie mogą mieć takich samych prędkości bo prędkości zmieniają się w wyniku zderzeń).
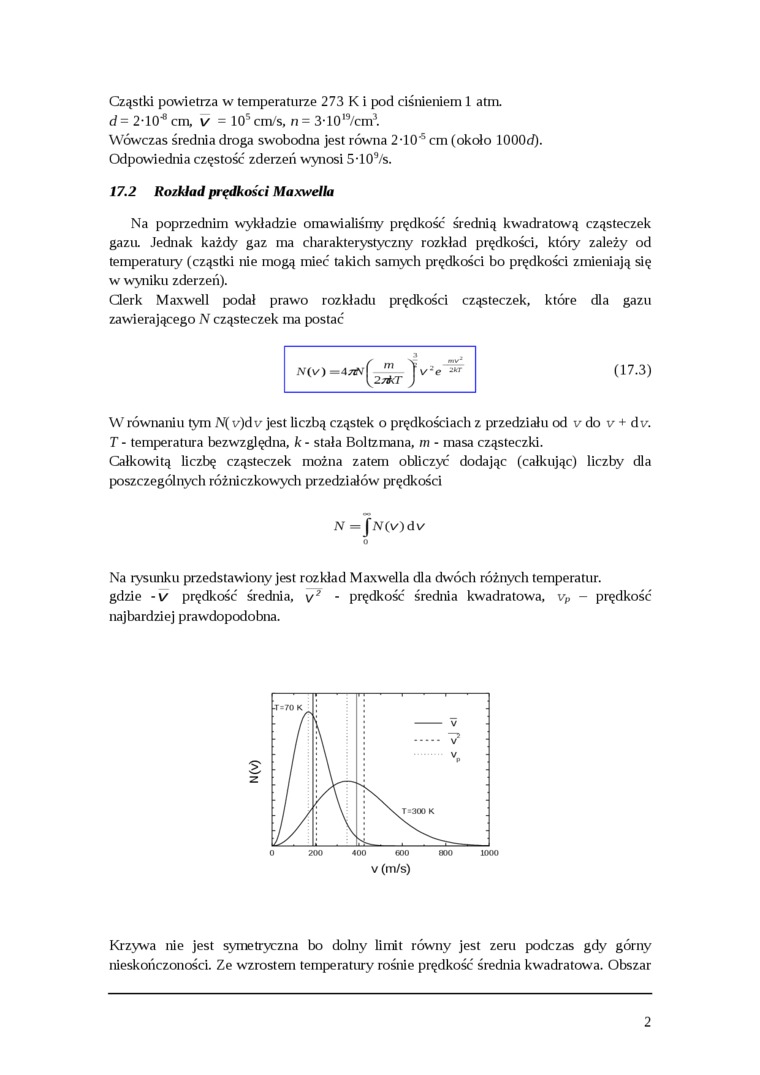
Clerk Maxwell podał prawo rozkładu prędkości cząsteczek, które dla gazu zawierającego N cząsteczek ma postać

(17.3)
W równaniu tym N( v)dv jest liczbą cząstek o prędkościach z przedziału od v do v + dv. T - temperatura bezwzględna, k - stała Boltzmana, m - masa cząsteczki.
Całkowitą liczbę cząsteczek można zatem obliczyć dodając (całkując) liczby dla poszczególnych różniczkowych przedziałów prędkości
N =jN(v)dt'
Na rysunku przedstawiony jest rozkład Maxwella dla dwóch różnych temperatur, gdzie -v prędkość średnia, y2 - prędkość średnia kwadratowa, vP - prędkość najbardziej prawdopodobna.
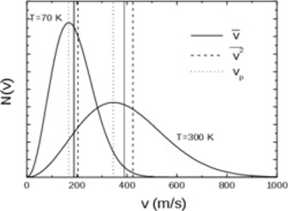
Krzywa nie jest symetryczna bo dolny limit równy jest zeru podczas gdy górny nieskończoności. Ze wzrostem temperatury rośnie prędkość średnia kwadratowa. Obszar
2
Wyszukiwarka
Podobne podstrony:
AGHWłaściwości fizyczne wody • Temperatura topnienia pod ciśnieniem 1 atm: 0°C =
CCF20090205�011 ) 4:. Dla reakcji N20< = 2N02 przebiegającej w temperaturze 273 K i pod ciśnienie
skan0104 Zadania 107 w temperaturze 298 K i 1000 K pod ciśnieniem 1 atm. Standardowe entalpie tworze
skan0040 (3) Zadania 2a:l. 2,35 dm3 wodoru w temperaturze 18°C i pod ciśnieniem 1012 hPa sprężono do
7. Obliczyć W, AS i AG, gdy 0,5 mola helu o temperaturze 298 K pod ciśnieniem *p° zostaje odwra
Data: Imię i Nazwisko: Zad. 1. Oblicz gęstość gazu w temperaturze 100°F pod ciśnieniem 1000 psi. sto
Zadanie 11. (0-1)i temperatury wrzenia (pod ciśnie„icm Wzór węglowodoru Temperatura topnienia
matura10�4 ZADANIE_l. W celu sprężenia lkg/s powietrza o temperaturze 290K, od ciśnienia lOOkPa do i
57448 MechanikaI5 Przykład 25. Jaką objętość zajmuje jeden mol gazu doskonałego w temperaturze 20°C
fizyczna5 1 Punkty: 0/2 Oblicz entropię molową CO w temperaturze 258.2 K, pod ciśnieniem 671184.6 Pa
więcej podobnych podstron