37422

w obszarze nieco ponad i poniżej płaszczyzny, w której leży oś wiązania. Przypadek ten przedstawia Rysunek 7.

Rysunek 7. Tworzenie się orbitalu molekularnego wiążącego n z dwóch orbitali atomowych 2pz W tej syhiacji energia elektronów, opisywanych przez orbital molekularny, który nosi nazwę orbitalu a jest niższa niż energia elektr onów w atomach izolowanych. Elektr ony nie znajdują się co prawda bezpośrednio pomiędzy jądrami atomów, ale tuż nad i pod płaszczyzną, w której leży o ś wiązania (prosta łącząca oba jądra). Orbitale typu n tworzą się wówczas, gdy dwa atom)' tworzą ze sobą wiązania wielokrotnie. Jedno z tych wiązań jest wiązaniem typu o. a pozostałe - wiązaniami typu n. I tak na przykład w cząsteczce tlenu O, (6 elektr onów walencyjnych) mamy do czynienia z utworzeniem się orbitalu molekularnego typu o z nakładania się dwóch orbitali typu px oraz orbitalu typu n powstałego z nakładania się dwóch orbitali typu pz. Każdy z tych orbitali jest obsadzony przez dwa elektron)', co odpowiada uproszczonemu opisowi wiązań w cząsteczce tlenu - powstają dwie wspólne pary elektronowe (wiązanie podwójne).
W cząsteczce azotu nakładają się zarówno orbitale 2px (orbital molekularny typu o), jak i orbitale typu 2py i 2pz (dwa prostopadle do siebie i prostopadłe do osi wiązania orbitale molekularne typu n). Jeśli każdy z tych trzech orbitali molekularnych zostanie obsadzony przez 2 elektrony, to otr zymamy wiązanie potrójne - trzy wspólne pary elektronowe atomów azotu.
W powyższych przykładach rozpatrzono tylko jednakowe orbitale. Nie było zatem problemu ze spełnieniem warunku jednakowej symetr ii nakładających się orbitali względem osi wiązania. Ponieważ jednak orbitale molekularne typu o mogą powstać zarówno z nakładania się orbitali typu s, jak i orbitali typu px (jedne i drugie są symetryczne względem osi wiązania - osi x), można zatem przypuszczać, że również nakładanie się tych dwócłr rodzajów' orbitali (przy spełnieniu warunku ..energetycznego") będzie prowadzić do utworzenia orbitali typu o (Rysunek 8).
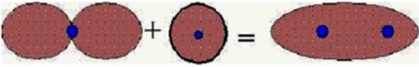
Rysunek 8. T\vorzcnie się orbitalu molekularnego wiążącego o z orbitali atomowych 2s i 2px Jak wynika z powyższych rozważań, posługując się teoną or bitali molekularnych rozpatrujemy najczęściej nakładanie się orbitali atomowych, które nie są całkowicie zapełnione. Analizując tworzenie się wiązań w cząsteczce, posługujemy się najczęściej diagratnetn energetycznym, obsadzając poziom)' odpowiadające orbitalom molekularnym elektronami przy zachowaniu tych samych reguł, co dla konfiguracji elektronowych w atomie. Na poniższych rysitttkach przedstawiono diagram)’ energetyczne dla cząsteczek wodoru, azotu i fluoru (strzałki reprezentują elektrorry o dodatnim lub ujemnym zwrocie spinu).

Rysunek 9. Diagram energetyczny dla cząsteczki wodom
W cząsteczce wodoru (konfrgirracja elektronowa atomu wodont w stanic podstawowym - ls1) twor zy się orbital wiążący typu o o energii niższej niż orbitale atomowe oraz orbital antywiąźący typu o* o energii odpowiednio wyższej. Para elektronów obsadza orbital wiążący; orbital antywiąźący pozostaje niewypełniony. Oznacza to, że sumaryczny skirtek energetyczny oznacza obniżenie energti dla cząsteczki w porównaniu z energią elektronów w izolowanych
Wyszukiwarka
Podobne podstrony:
Marta Maro-Kulczycka Obszary poznane na studiach były celem 57 wyjazdów, czyli nieco ponad 12% ogółu
zrzutekranu 1 Są to obszary ubogie w opady (poniżej 125 mm rocznie), a temperatura waha się w szerok
I. ZAKOPANE.A. Położenie, obszar i ludność. Zakopane (Galicya, pow. Nowotarski), leży pod 49° i8
PZP 1918 1994 s20 im Zachodzie i Północy kraj został okrojony terytorialnie. Jego nowa powierzchnia
page0105 101 kszego, ogólniejszego. Ponieważ wszystkie te układy znajdują się w tej samej płaszczyźn
Cechy siły jako wielkości wektorowej: • kierunek - prosta, na której leży wektor,
IMAG0441 (2) Płaszczyznę przekroju elementów niemetalowych można oznaczać w sposób przedstawiony pon
Grzegorz Gómiewicz publicznego o nieco ponad 0,3% PKB41 i tym samym oddalenie nieco niebezpieczeństw
krótkookresową krzywą Philipsa, na której leży punkt odpowiadający stanowi równowagi długookresowej
więcej podobnych podstron