41973

2
T lnR-lnfL [K]
ln R„
- 9,276298 ± 0,027936; b = 3718,57± 8,41; R - zmierzyłam opór w czasie wykonywania doświadczenia
W mniejszych tabelach podałam wartości napięcia i natężenia odnotowane w momentach wskazanych w instrukcji, o czym świadczą liczby porządkowe (Lp.).
Obliczam średnie wartości pojemności cieplnej dla etapu I i II:
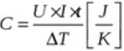
U - napięcie; T - czas; AT - różnica temperatur; U - napięcie;
Etap I:
1= 214 [mA] =0,214 [A] U= 19,8 [V] t= 120 [s]
AT = 0,2 [K]
C=2542,3 IJ/K1
Etap II:
1=217 [mA] =0,217 [A] U= 20,0 [V] t= 180 [s]
AT = 0,5 [K] C=15G2,4 IJ/KJ
Kolejno obliczam pojemności cieplne dla etapów I oraz II:
Uxlx J mr >AT kg xK
m, - masa roztworu 0,5 molamego; m,=515,2 [g] = 0,5152 [kg]
Etap I:
C p=4934,G [J/kg*K]
Etap II:
Cp=3032,6 [J/kg*Kl
Średnia pojemność cieplna (właściwa) roztworu wynosi:
Cu,,= 3983,6 IJ/kg*Kl
❖ OMÓWIENIE BŁĘDÓW.
ACp = ±
/*
m. >AT
xAU +
UX
m. >AT
At= 1 [s]; AD = 0,5 [V];
xAI +
U
m. x&T
xAt +
gdzie: Al = 0,01 [A];
Uxlx
m^AT)
>AT +
UxiX-xAT W
m2 >{AT) nr
xAm.
AT = 0,01 [K]; Am, = 0,01 [g];
Wyszukiwarka
Podobne podstrony:
IMAG2885 //f 9 37/ćsc^y fpo a/J£? 2£n **1 JIFn r sr-.± ) I Af^^O * -/
Oaoineii mljWmcJtfsc* r <°rz G)Cj H*± y « _ Hy - Vft . 2.02 .3?-1 • U&b 1 /i.aoa
B 3 -4.: „w ;X>ĄX$rZ rJ- ■ A„ f> ,,v. r r~, ~--L _2i_b€Ł---LooUa^- • #8?. TOtuCpCo)c bet ■
B ln« Ed<w - C.ŁiftofingtjopUnttiinb - □ X IJEEEE1S iMStRT
IMAG2885 //f 9 37/ćsc^y fpo a/J£? 2£n **1 JIFn r sr-.± ) I Af^^O * -/
BSO Naruto Front EMG ^ /( 11, ~~rrrA UM / «- m. ^pp* ✓* y/ki i fr jJMLCnr ŁJy.^rZ i^jg&quo
** i Sftaaag - v’. p WĄ/łvv■ jŁ A» id Vvj * ‘-ii S> 1^41 .- JF^o <, i ^ ’. -j ^ < ■ i V
sarnyul1 i ? ^ # © ■« n c m □ :: Źf l1* N: 52° 41* 24.73" E: 19° V 5.64" . X 5840189.13 Y
86185 Zdjęcie0160 (6) ■ ■a i*. 4 V I I I lana kultury funkcjonowania firmy, zmierzająca do oni
88829 Zdjęcie705 14 I I IP~.)Ji U5 i e * (« i ) 1e" J «a%yf k- 0* O fffŁ
Database Ęditor View Visualization Options Help _ □ file (jcwpd_0_r] - BaseX 8.2.1 ■41
więcej podobnych podstron