49703
Równanie Van der Izaaka
Równanie stanu gazu doskonałego
pV = nRT
dobrze opisuje gazy rzeczywiste ale przy małych gęstościach. Pizy większych gęstościach nie można pominąć fałdu, że cząstki zajmują część objętości dostępnej dla gazu oraz że zasięg sil międzycząsteczkowych może być większy niż odległości międzycząsteczkowe.
J.D. Van der Waals wprowadził zmienione równanie stanu gazu, które uwzględnia te czynniki Jeżeli cząstki posiadają skończoną objętość to rzeczywista objętość dostępna dla cząstek jest mniejsza od objętości naczynia. "Objętość swobodna" jest mniejsza od objętości naczynia o "objętość własną" cząsteczek b. Jeżeli oznaczymy przez v objętość przypadającą na jeden mol v=V/n to otrzymamy zmodyfikowane równanie stanu gazu
p(v-b) = RT
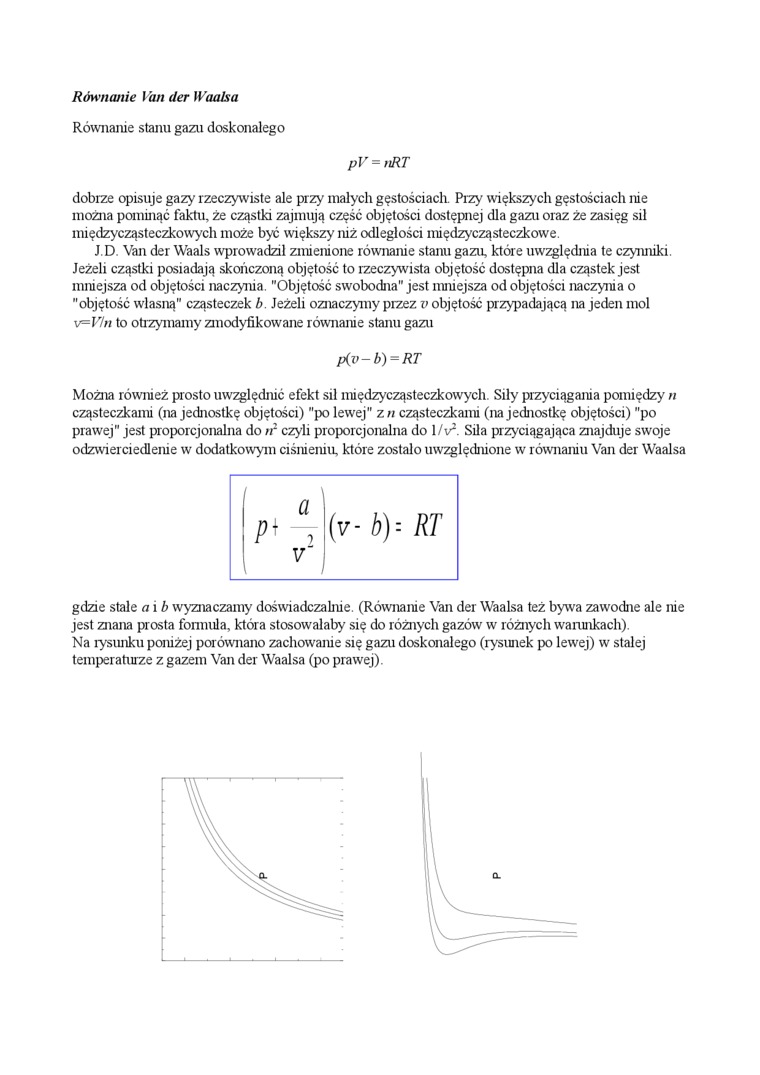
Można również prosto uwzględnić efekt sil międzycząsteczkowych. Siły przyciągania pomiędzy « cząsteczkami (na jednostkę objętości) "po lewej" z n cząsteczkami (na jednostkę objętości) "po prawej" jest proporcjonalna do /r czyli proporcjonalna do 1/iA Siła przyciągająca znajduje swoje odzwierciedlenie w dodatkowym ciśnieniu, które zostało uwzględnione w równaniu Van der Waalsa
gdzie stale a i b wyznaczamy doświadczalnie. (Równanie Van der Waalsa też bywa zawodne ale nie jest znana prosta formula, która stosowałaby się do różnych gazów w różnych wantnkach).
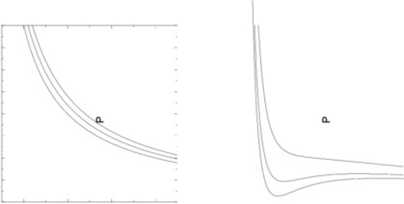
Na rysunku poniżej porównano zachowanie się gazu doskonałego (rysunek po lewej) w stałej temperaturze z gazem Van der Waalsa (po prawej).
Wyszukiwarka
Podobne podstrony:
2.3. Współczynnik ściśliwości Równanie stanu gazu doskonałego: pV = nRT
PB260125 Równanie Van der Waalsa Równanie gazu doskonałego p —nRT dobrze opisuje gazy rzeczywiste p
HP8 strona6 / e = c, P Vp Rm (10) Natomiast po podstawieniu równania stanu gazu doskonałego do równ
P1010014 (2) , 2.5. Równanie stanu gazu doskonałego4- fi otrzymujemy: pub pv nvtr = Nkr J « «(aV f
Z równania stanu gazu doskonałego wynika, że P Podczas przemiany izobaiycznej stałe jest ciśnienie i
Skorzystamy z równania stanu gazu doskonałego w celu zapisania wyrażenia pozwalającego wyznaczyć Tc.
Dsc01082(1) 24. Równanie stanu gazu doskonałego to: v NR<3>pr‘— B) /?/? P _AT V . __ RN01
e = c. P-V
moodle fizyczna 4 1 1 Punkty: 1/1 8 moli gazu spełniającego równanie stanu gazu doskonałego sprężono
DS11111111 Kolokwium Termodynamika lechnic/na ET1 wykłady I 01 Omówić Równanie stanu gazu doskonałeg
Slajd1 Równanie stanu gazu doskonałegopV=nRT J mol K p - bezwzględna wartość ciśnienia n - liczba mo
Obiegi gazowe w maszynach cieplnych PRZEMIANY I PRAWA GAZOWE Równanie stanu gazu doskonałego (równan
więcej podobnych podstron