Obliczenia:
Obliczam współczynnik podziału jodu pomiędzy toluen i wodę ze wzoru:
K1 = 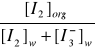
= ![]()
K1i =
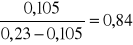
K1i =
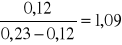
K1i =
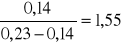
K1i =
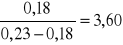
K1i =
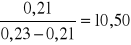
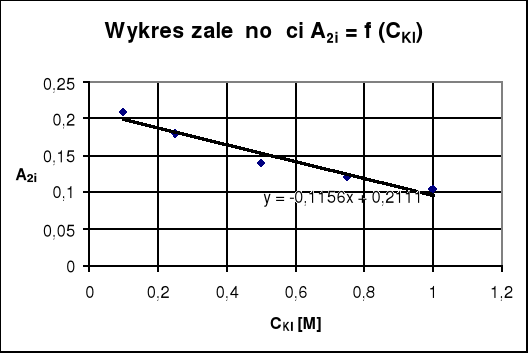
Odczytana z wykresu metodą ekstrapolacji wartość A2o = 0,2111
Obliczam współczynnik podziału jodu pomiędzy rozpuszczalnik organiczny i wodę ze wzoru:
K = 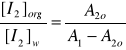
K = ![]()
Wartości ![]()
dla kolejnych pomiarów wynoszą:
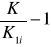
=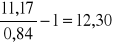
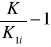
=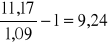
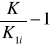
=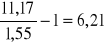
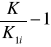
=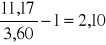
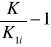
=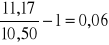
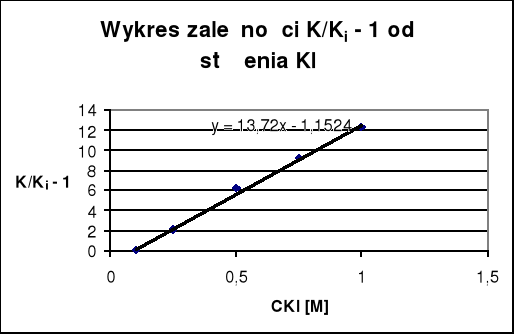
Współczynnik kierunkowy prostej obrazującej zależność ![]()
od CKI przedstawionej wykresem nr 2 jest równy stałej równowagi reakcji Kc.
Obliczam stałą Kc ze wzoru:
Kc = 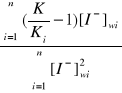
Kc=![]()
![]()
![]()
Wnioski:
Celem ćwiczenia było wyznaczenie stałej równowagi reakcji J2 + I- ![]()
I![]()
na podstawie pomiarów stałych podziału jodu pomiędzy wodny roztwór jodku i ciecz organiczną, nie mieszalną z wodą. W tym celu należy oznaczyć współczynnik podziału pomiędzy rozpuszczalnik organiczny i wodę K, oraz współczynnik podziału jodu K1 pomiędzy rozpuszczalnik organiczny i wodne roztwory KI. W ćwiczeniu należało przygotować wodne roztwory jodku potasu, następnie do każdego z nich dodać tę samą objętość jodku w toluenie , potem wstrząsnąć i pozostawić do rozwarstwienia na kilka minut. Kolejną czynnością było pobranie z każdej kolbki za pomocą suchych pipetek kilku mililitrów warstwy cieczy organicznej (czyli warstwy górnej - jodu w toluenie) i przeniesienie do kiuwety kolorymetru. Za pomocą spektrofotometru zmierzyłam absorbancję (ekstynkcję) A2 każdej pobranej próbki oraz absorbancję A1 wyjściowego roztworu jodu. Wartość absorbancji należy odczytać ze skali przyrządu. Przed każdym pomiarem (gdy w kiuwecie znajdował się toluen) ustawiałam wskazówkę przyrządu na wartości ″0″.
Zasada pomiaru spektrofotometrycznego polega na określeniu natężenia światła monochromatycznego przed i po przejściu przez kiuwetę zawierającą układ reakcyjny (roztwór jodu w rozpuszczalniku organicznym - toluenie). Zależność zwana prawem Lamberta - Beera wiąże wielkości mierzone ze stężeniem substancji absorbującej światło.
A = log ![]()
= Ao * C * l
gdzie:
A - absorbancja roztworu
Jo, J - natężenia światła padającego i opuszczającego próbkę
Ao - molowy współczynnik absorbancji [![]()
] zależny od długości
fali , przy której prowadzony jest pomiar
C - stężenie molowe
l - długość drogi optycznej (grubość kiuwety) w cm.
Wynika z tego, że absorbancja jest wprost proporcjonalna do stężenia substancji absorbującej. Prawo to stosuje się do roztworów rozcieńczonych.
Stała równowagi Kc jest współczynnikiem kierunkowym prostej będącej zależnością stężenia KI od ![]()
przedstawionej na wykresie nr 2. Wartość stałej równowagi Kc reakcji obliczona metodą najmniejszych kwadratów wynosi w moim przypadku 12,16.
W trakcie wykonywania ćwiczenia mogły zostać popełnione błędy podczas przygotowywania wodnych roztworów KI wynikające z niedokładności odczytu objętości KI i wody z przyrządów pomiarowych, a także podczas dodawania do nich roztworu jodu w toluenie (wyszczerbiona pipeta utrudniała dokładne nabieranie cieczy). Również wartości absorbancji odczytane ze skali kolorymetru mogą być obarczone błędami pomiarowymi wynikającymi z niedokładności odczytu (niedokładność ludzkiego oka). Bez względu na błędy mogę powiedzieć, że ćwiczenie zostało przeprowadzone prawidłowo i zgodnie z instrukcją.
Wyszukiwarka
Podobne podstrony:
chemia fizyczna laboratoria, Lab.33, fhfddddhhhhhhh
zagadnienia lab fiz, WIiTCh PK, Technologia Chemiczna, semestr 3, Chemia Fizyczna, laboratorium
Wzór sprawozdania chemfiz lab, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratoriu
19 obliczenia, chemia fizyczna laboratorium, 19
16 obliczenia + wnioski, chemia fizyczna laboratorium, 16
SEM ogniwa1, Technologia chemiczna, Chemia fizyczna, Laboratorium, inne, SEM ogniwa
wpływ stężenia i temperatury na lepkość roztworów, Chemia fizyczna, laboratorium, Chemia fizyczna
Ćwiczenie 1 - oznaczanie stalej i stopnia dysocjacji, Biotechnologia PWR, Semestr 3, Chemia fizyczna
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
chemia fizyczna laboratoria, iwona chem. fiz. ćw. 91
Badanie równowagi fazowej w układzie trójskładnikowym 8.3, Technologia chemiczna, Chemia fizyczna, l
elektrolityzadania st, Technologia chemiczna, Chemia fizyczna, laboratorium
chemia fizyczna laboratoria, 95,94, 97
chemia fizyczna laboratoria, 31,32,33vigora, 97
chemia fizyczna laboratoria, 16Ania, ffffff
chemia fizyczna laboratoria, KOND42, 97
więcej podobnych podstron